CANTIM DA PNEUMOLOGIA (PARTE 3)
- Dylvardo Costa Lima

- 13 de ago. de 2021
- 84 min de leitura
Atualizado: 28 de ago. de 2023

Imagens de satélite mostram que a Floresta Amazônica está se aproximando de um "ponto de inflexão"
Artigo publicado na Nature Climate Change em 07/03/2022, em que um pesquisador alemão e dois britânicos comentam, que mais da metade da floresta tropical pode se transformar em savana em poucas décadas, ameaçando a vida selvagem, mudando os padrões climáticos e alimentando ainda mais as mudanças no clima do planeta.
Vista do espaço, a floresta amazônica não parece um ecossistema à beira do precipício. As nuvens ainda se aglutinam com a respiração de cerca de 390 bilhões de árvores. Rios serpenteiam pelo que parece ser um mar de verde sem fim. No entanto, imagens de satélite tiradas nas últimas décadas revelam, que mais de 75% da floresta tropical está perdendo resiliência, de acordo com um estudo publicado na segunda-feira na revista Nature Climate Change. A vegetação é mais seca e leva mais tempo para se regenerar, após uma perturbação. Mesmo as áreas mais densamente florestadas, lutam para se recuperar.
Essa fraqueza generalizada oferece um sinal de alerta precoce, de que a Amazônia está chegando ao seu “ponto de inflexão”, dizem os autores do estudo. Em meio ao aumento das temperaturas e outras pressões humanas, o ecossistema pode sofrer uma morte súbita e irreversível. Mais da metade da floresta tropical poderia ser convertida em savana em questão de décadas, uma transição que colocaria em risco a biodiversidade, mudaria os padrões climáticos regionais, e aceleraria drasticamente as mudanças climáticas.
Historicamente, a Amazônia tem sido um dos “sumidouros de carbono” mais importantes da Terra, retirando bilhões de toneladas de dióxido de carbono do ar, e armazenando-o na vegetação. Os pesquisadores temem que a liberação repentina desse carbono colocaria a meta climática mais ambiciosa da humanidade, limitar o aumento da temperatura a 1,5 graus Celsius (2,7 graus Fahrenheit), fora de alcance.
“Como cientista, não devo ter ansiedade. Mas depois de ler este artigo, estou muito, muito ansioso”, disse Carlos Nobre, cientista climático do Instituto de Estudos Avançados da Universidade de São Paulo, que não esteve envolvido na nova pesquisa. “Este artigo mostra que estamos indo na direção completamente errada. Se ultrapassarmos o ponto de inflexão, isso é uma notícia muito ruim.”
A Amazônia é um dos vários “elementos decisivos” no clima global, dizem os cientistas. Em vez de piorar constantemente à medida que o planeta aquece, esses sistemas têm o potencial de mudar abruptamente de uma fase para outra, possivelmente com muito pouco aviso. Nos últimos 50 milhões de anos, a Amazônia esteve em uma fase de floresta úmida. As próprias árvores garantiam sua existência: a água evaporando das folhas criava um ciclo interminável de chuva, enquanto o dossel denso impedia que a luz do sol secasse o solo. Os contornos da floresta podem ter mudado um pouco em resposta às eras glaciais, incêndios florestais e aumento do nível do mar, mas sempre foi capaz de retornar ao seu estado exuberante e verdejante.
No entanto, o aquecimento causado pelo homem e o desmatamento, sequestraram esse sistema de auto-reforço. As condições mais quentes no Oceano Atlântico, estenderam a estação seca da Amazônia em várias semanas. Ao derrubar cerca de 17% de suas árvores, as pessoas minaram o mecanismo de reciclagem de água da floresta. As árvores estressadas pela seca, são mais vulneráveis aos incêndios florestais. E quanto mais árvores morrem, menos chuva cai, o que por sua vez piora a morte de árvores. A certa altura, o ecossistema perderá mais árvores do que pode recuperar, nessas condições quentes e secas. A floresta tropical escura, densa e úmida, dará lugar a uma savana mais aberta.
O matemático Niklas Boers, que contribuiu para o novo artigo, comparou-a a alguém recostado em uma cadeira. Se essa pessoa não se inclinar muito, a cadeira pode facilmente voltar a ter as quatro pernas no chão. Mas uma vez que se passe do ponto de inflexão, todo o sistema entra em colapso. E é muito mais difícil levantar-se de novo, do que cair.
As imagens de satélite que Boers e seus colegas analisaram, sugerem que a Amazônia ainda está oscilando à beira do tombamento, dizem os cientistas. Observando trechos de floresta com pelo menos 80% de cobertura arbórea de folhas largas, áreas que não foram fortemente afetadas pelo desmatamento, os pesquisadores descobriram que a grande maioria dos trechos florestais se recupera mais lentamente após flutuações sazonais, do que há 20 anos. As áreas mais secas do sul da floresta tropical, bem como as mais próximas às estradas, sofreram mais.
“A perda de resiliência que observamos significa, que provavelmente nos aproximamos desse ponto crítico”, disse Boers, que estuda a dinâmica do sistema terrestre na Universidade Técnica de Munique e no Instituto Potsdam, para Pesquisa de Impactos Climáticos. “Mas também significa que não passamos do ponto de inflexão, então há esperança.”
O artigo da Nature Climate Change não aponta quando a Amazônia pode cruzar esse limite perigoso. Mesmo uma vez que o ecossistema tenha sido completamente desestabilizado, ele pode persistir até que uma força externa, por exemplo, um megaincêndio ou uma seca severa, o leve ao limite. O momento de não retorno pode não ser óbvio, até que seja tarde demais para fazer alguma coisa, disse o principal autor Chris Boulton, cientista climático da Universidade de Exeter.
“Meu amigo usa a ideia de Wile E. Coyote correndo de um penhasco”, disse Boulton. “Ele parece bem, e de repente olha para baixo e percebe que caiu do penhasco.” É isso que torna este estudo, a primeira avaliação empírica de instabilidade em toda a floresta tropical, tão valioso, acrescentou. “Se estamos mostrando que um desses sistemas está se movendo em direção a um ponto de inflexão, isso pode fazer as pessoas acordarem”, disse Boulton.
Para os 10% das espécies conhecidas que vivem na Amazônia, a perda da floresta tropical pode sinalizar uma sentença de morte. A morte catastrófica colocaria em perigo milhões de pessoas que dependem do ecossistema para se alimentar; 70% da chuva que cai no norte da Argentina, um celeiro sul-americano, vem de árvores amazônicas.
Exceder o ponto de inflexão da Amazônia, também desencadearia vários anos de poluição global por gases de efeito estufa na atmosfera. Estudos já mostram que algumas áreas da Amazônia, estão produzindo cerca de 300 milhões de toneladas a mais de carbono do que retiram do ar, uma quantidade aproximadamente igual às emissões anuais do Japão.
As consequências do aquecimento pela perda repentina de metade da floresta tropical, seriam sentidas a milhares de quilômetros de distância e por séculos no futuro, alertam os cientistas. Isso significaria tempestades crescentes e incêndios florestais agravados, escassez crônica de alimentos, e quase 30 centímetros de aumento do nível do mar inundando as comunidades costeiras. Pode desencadear outros pontos de inflexão, como o derretimento das camadas de gelo ou a interrupção da monção sul-americana.
No entanto, ao contrário dos mantos de gelo e dos sistemas de monções, que respondem apenas à quantidade de calor que os humanos estão prendendo na atmosfera da Terra, a Amazônia está sendo empurrada para seu ponto de inflexão por duas forças: desmatamento e mudança climática. Isso também dá uma maior esperança ao pesquisador, porque significa que a humanidade tem duas estratégias para proteger o ecossistema.
“Se tirarmos um desses fatores da equação, minha intuição seria de que o sistema seria capaz de lidar com isso”, disse ele. “É exatamente isso que se deve dizer aos governos brasileiro, colombiano e peruano: parem o desmatamento hoje.”

À medida que as tropas russas entram na Ucrânia, precisamos nos lembrar do impacto da guerra na saúde
Comentário publicado na British Medical Journal em 25/02/2022, por um pesquisador britânico especialista em Ética e Direitos Humanos.
Os efeitos da guerra na saúde são íntimos e gerais. Os impactos na saúde são imediatos, pessoas são feridas e mortas, e então os impactos se espalham para fora, no espaço e no tempo. As repercussões ecoam através das vidas individuais e, com demasiada frequência, ao longo das gerações. Nos primeiros minutos, horas e dias de uma guerra com hostilidades militares, o trauma físico é primário: corpos humanos individuais são mutilados pela ferocidade das munições modernas. Vidas terminam ou são mudadas para sempre. Apesar de toda a conversa sobre armas “inteligentes” e ataques direcionados, os primeiros ataques raramente se restringem aos combatentes.
Conflitos recentes, como os do Grande Oriente Médio, arrastaram um grande número de cidadãos para o turbilhão, com efeitos devastadores. Conflitos em Ruanda e Kosovo na década de 1990, viram até 90% das mortes entre civis. É difícil compreender a escala de abate desencadeada pela guerra industrial e tecnológica: o século 20 viu uma estimativa de 191 milhões de mortes relacionadas a conflitos, aproximando-se da metade da população atual da Europa.
Os impactos da guerra na saúde não param com o trauma dos combates. Estimativas grosseiras sugerem que para cada pessoa morta diretamente pela guerra, nove serão mortas indiretamente, embora muito dependa da natureza do conflito, e das condições subjacentes de saúde nos países em que é travada. Mesmo que a Ucrânia seja poupada do direcionamento direto de suas instalações de saúde, o impacto nos serviços de saúde e na saúde pública, provavelmente será devastador, principalmente se o conflito se espalhar pelas áreas urbanas. A infraestrutura civil é extremamente vulnerável ao conflito moderno. Com o transporte impedido, o fluxo de bens essenciais de saúde interrompido e os profissionais de saúde e pacientes impossibilitados de se deslocar, os resultados de saúde, particularmente e inicialmente entre mulheres grávidas e crianças pequenas, se deteriorarão rapidamente, sabemos que a mortalidade infantil e relacionada ao nascimento é duramente atingida por conflito armado.
Sem uma interrupção rápida das hostilidades, uma cascata de problemas de saúde de longo prazo será iniciada. Onde a infraestrutura civil, incluindo o acesso a água potável, saneamento e um suprimento estável de alimentos, é interrompida, as doenças infecciosas ressurgem. Sem surpresa, o comportamento humano muda durante o conflito, e as doenças não transmissíveis associadas a comportamentos mais arriscados, aumentam. Os impactos na saúde mental do conflito provavelmente serão extremos.
O povo ucraniano vive com ansiedade sobre as intenções de seu poderoso vizinho há muitos anos. Eles assistiram a Rússia anexar a Crimeia, e travar guerras nas províncias de Donetsk e Luhansk, no leste da Ucrânia. Eles sabem que estão sem proteção ocidental direta. E agora, à medida que uma guerra de invasão começa, os efeitos na saúde mental serão sérios e duradouros. As pessoas diretamente envolvidas no conflito estarão em risco imediato de transtorno de estresse pós-traumático, mas a depressão, a ansiedade e outras condições relacionadas ao estresse, incluindo o uso abusivo de álcool e drogas, também aumentarão e, mais uma vez, podem ter impactos duradouros e até intergeracionais.
Como sabemos de conflitos recentes, os efeitos da guerra na saúde podem ser deslocados, para muito além das fronteiras dos países envolvidos. Entre as questões globais mais significativas em saúde e direitos humanos, surgem as necessidades de saúde de milhões de pessoas deslocadas por conflitos modernos. As pessoas que saem das zonas de guerra levam consigo seus traumas. Eles sofrem terrivelmente nas rotas de migração para as partes mais estáveis do mundo. Eles são vítimas de uma série de doenças infecciosas, lutam para encontrar alimentos nutritivos e moradias que possam sustentar a saúde.
O povo da Ucrânia foi vítima de sucessivos regimes brutais. No Holodomor, ou grande fome de 1932-33, três milhões e meio de ucranianos foram mortos pela política deliberada de fome de Stalin. Hitler invadiu a Ucrânia em junho de 1941, três milhões e meio de cidadãos ucranianos foram mortos durante os anos de ocupação alemã. Milhões de ucranianos morreram como soldados do Exército Vermelho. Mais uma vez a Rússia procura incorporá-la, custe o que custar, em sofrimento humano. Não é surpresa que o historiador Timothy Snyder tenha chamado seu livro sobre a Ucrânia e seus territórios vizinhos de Terras de Sangue.
A guerra destrói mais do que corpos e mentes. Rasga as raízes do bem-estar humano, rasga o tecido da comunidade humana, rompe os laços entre as pessoas e os lugares que habitam. E deixa um legado duradouro. A guerra contamina os locais de habitação humana física e psicologicamente. A memória traumática pode tornar impossível a busca pela paz. E sem paz não pode haver esperança real de saúde humana ou florescimento. Esta invasão não é apenas uma tragédia para os ucranianos de hoje. Também dependerá fortemente do bem-estar das gerações futuras.

Bronquite Plástica Linfática
Um homem de 36 anos com obesidade apresentou-se à clínica pulmonar com história de 3 anos de falta de ar, sibilos e “tosse pulmonar”. Ele relatou ter expectoração diária de grandes moldes brônquicos ramificados e trouxe uma fotografia de tal gesso para a consulta.
Sua saturação de oxigênio era de 85% enquanto respirava ar ambiente e sua frequência respiratória era de 16 respirações por minuto. À ausculta, sibilos dispersos foram ouvidos em todos os campos pulmonares.
Ele foi internado no hospital para receber oxigênio suplementar e passar por nova avaliação. A tomografia computadorizada de tórax mostrou opacidades em vidro fosco difusas. A análise histopatológica de uma amostra de lavado broncoalveolar revelou tampões de muco com predominância de neutrófilos e macrófagos carregados de lipídios sem evidência de infecção bacteriana, fúngica ou micobacteriana.
Os resultados de uma investigação diagnóstica para aspergilose broncopulmonar alérgica, fibrose cística, doença falciforme e asma foram normais. Posteriormente, o paciente foi submetido a linfangiografia por ressonância magnética dinâmica com contraste, que revelou oclusão do ducto torácico, achado que sugeriu o diagnóstico de bronquite plástica linfática.
Embora a bronquite plástica geralmente se manifeste durante a infância, o distúrbio pode ocorrer em adultos como resultado do fluxo linfático pulmonar aberrante e pode levar à asfixia fatal se não for tratada. O paciente foi submetido à embolização linfática percutânea e teve resolução completa dos sintomas.

Os cigarros eletrônicos devem ser licenciados como medicamentos?
Debate aberto publicado na British Medical Journal em 12/01/2022, em que pesquisadores britânicos comentam PRO e CONTRA o licenciamento medicinal de cigarros eletrônicos no Reino Unido.
Enquanto o Reino Unido anuncia o apoio ao licenciamento medicinal de cigarros eletrônicos, Nicholas S Hopkinson argumenta que isso dará aos médicos, outros meios para ajudar os fumantes a parar de fumar. Mas Jørgen Vestbo, Andrew Bush e Jonathan Grigg dizem, que seu benefício não é comprovado e que os danos são prováveis.
Sim—Nicholas S Hopkinson
Um anúncio recente da Agência Reguladora de Medicamentos e Produtos de Saúde do Reino Unido (MHRA), que “procura incentivar o licenciamento de cigarros eletrônicos, e outros produtos inalados contendo nicotina como medicamentos, e visa apoiar as empresas a enviar pedidos de autorização de comercialização para esses produtos ”, deve ser bem-vindo.
Os cigarros eletrônicos são sistemas eletrônicos de liberação de nicotina: os usuários inalam o vapor criado pelo aquecimento de um líquido contendo um umectante (propilenoglicol ou glicerina vegetal), nicotina e aromatizantes.
Embora nenhum comentarista sério descreva os cigarros eletrônicos como “completamente seguros”, o mais tóxico, o componente da fumaça do tabaco, as partículas sólidas de alcatrão, bem como o monóxido de carbono, estão completamente ausentes do vapor do cigarro eletrônico. Os níveis de exposição dos usuários a outros constituintes, são ordens de magnitude mais baixos do que em pessoas que fumam. Por esse motivo, o Comitê Independente de Toxicidade de Produtos Químicos em Alimentos, Produtos de Consumo e Meio Ambiente (COT) do governo do Reino Unido, descreve o risco relativo de efeitos adversos à saúde efeitos do vaping sejam “substancialmente menores” do que os do fumo.
Risco “substancialmente menor”
Os cigarros eletrônicos já estão amplamente disponíveis, e são regulamentados como produtos de consumo, de acordo com a Diretiva de Produtos de Tabaco da UE, que foi incorporada à lei do Reino Unido. Cerca de 3,9 milhões de pessoas no Reino Unido usam cigarros eletrônicos, dois terços dos quais agora são ex-fumantes. O vaping por pessoas que nunca fumaram continua sendo raro, e em crianças e jovens, é quase exclusivamente realizado entre aqueles que foram fumantes ou ainda são. No entanto, dados de pesquisas mostram que quase um terço dos fumantes nunca experimentou cigarros eletrônicos, e cerca de um terço dos fumantes acredita incorretamente, que eles são pelo menos tão prejudiciais quanto o tabagismo convencional.
Atualmente, os dispositivos regulamentados pelo consumidor, não podem ser promovidos como auxiliares de cessação do tabagismo. Por outro lado, os cigarros eletrônicos que passaram pelo processo MHRA, e são regulamentados como medicamentos, seriam elegíveis para essa alegação terapêutica, em comum com outras formas licenciadas de terapia de reposição de nicotina. Os dispositivos licenciados clinicamente, têm o potencial de serem mais eficazes do que os dispositivos de consumo, porque podem ser disponibilizados em concentrações superiores às permitidas para produtos de consumo (ou seja, contendo mais de 20 mg/mL de nicotina). Uma revisão sistemática da Cochrane Collaboration, já suporta cigarros eletrônicos existentes como um auxílio para parar de fumar, assim como as orientações recentemente atualizadas do Instituto Nacional de Excelência em Saúde e Cuidados.
A terapia de reposição de nicotina, é substancialmente mais eficaz no contexto de suporte comportamental, o que também deve ser o caso, quando a reposição de nicotina vem como um cigarro eletrônico. O processo MHRA deve fornecer mais garantias aos profissionais de saúde, de que eles podem ajudar seus pacientes a parar de fumar dessa maneira, principalmente em ambientes de saúde mental, onde as taxas de tabagismo permanecem altas.
A introdução de cigarros eletrônicos, que passarem por um processo de licenciamento medicinal mais rigoroso, provavelmente aumentará a confiança entre os fumantes, que até agora relutam em tentar essa abordagem, além de reverter falsas crenças sobre danos relativos quando comparados ao tabagismo, crenças que têm se alimentado por relatórios imprecisos e irresponsáveis.
Uma das muitas ferramentas
É importante enfatizar que os cigarros eletrônicos licenciados por médicos, à medida que estiverem disponíveis, serão apenas uma entre muitas ferramentas para apoiar a cessação do tabagismo, incluindo vareniclina, bupropiona e terapia de reposição de nicotina combinada, todas idealmente entregues no contexto de tratamento psicológico e apoio à mudança de comportamento. Seu uso neste contexto também provavelmente aumentaria a taxa de mudança completa do tabagismo para o vaping, em oposição ao uso duplo, e também pode ajudar os usuários a definir uma meta de limitar o vaping a longo prazo. As pessoas que usam o vaping também são aconselhadas a parar de fumar eventualmente, mas sem correr o risco de voltar a fumar.
Também é importante garantir, que o debate em torno dos cigarros eletrônicos, não distraia de outras tarefas necessárias para alcançar a ambição do Reino Unido de se livrar do fumo até 2030, como a introdução de uma taxa “poluidor-pagador” sobre os lucros da indústria do tabaco, e aumentar a idade de venda de 18 a 21. Para serem sustentáveis, os sistemas de saúde e outros sistemas devem reduzir danos futuros evitáveis. Ainda há mais de seis milhões de pessoas que fumam no Reino Unido: o licenciamento medicinal de cigarros eletrônicos pode ajudar muitas delas a viver mais e com mais qualidade de saúde.
Não—Jørgen Vestbo, Andrew Bush e Jonathan Grigg
Já existe dependência de nicotina suficiente. Por décadas, as taxas de tabagismo no Reino Unido vêm diminuindo, e poucos adolescentes se veem se tornando fumantes. Isso foi alcançado sem os cigarros eletrônicos, e o declínio do tabagismo não acelerou após a introdução dos cigarros eletrônicos.
Se amanhã todos os fumantes parassem e mudassem para cigarros eletrônicos, concordamos que menos pessoas provavelmente teriam doenças respiratórias. No entanto, fumar continuado não é um comparador adequado ao vaping. Temos um arsenal de ferramentas baseadas em evidências, como aumentos adicionais na tributação e diminuição da disponibilidade, que podem reduzir ainda mais a prevalência do tabagismo, com muito menos risco de efeitos adversos à saúde conhecidos e desconhecidos.
Sem endosso científico e profissional
Nenhum país do mundo além do Reino Unido, licenciou cigarros eletrônicos como drogas, e por boas razões. Os cigarros eletrônicos como um auxílio para a cessação do tabagismo, não foram endossados por uma única grande sociedade científica respiratória ou pediátrica, porque sua eficácia na cessação do tabagismo não é comprovada, e notavelmente pouco estudada.
No estudo mais citado comparando cigarros eletrônicos com produtos de nicotina medicinal, os cigarros eletrônicos foram superiores, mostrando uma taxa de abstinência de um ano de 18%, em comparação com 10%. No entanto, descobriu-se que duas vezes mais pessoas nos grupos de reposição de nicotina “antiquados” abandonaram completamente a nicotina, já que as pessoas que usam cigarros eletrônicos tendem a continuar no vaping, enquanto a maioria das pessoas que usam produtos medicinais de nicotina desiste.
Há também o fenômeno do “uso duplo”: os fumantes param usando cigarros eletrônicos e depois voltam a fumar enquanto continuam vaping. No estudo mais citado, 40% das pessoas designadas para cigarros eletrônicos ainda os usavam após um ano, e mais da metade desses vapers também eram fumantes. (O grupo Tobacco Tactics da Universidade de Bath observou que a indústria do tabaco adora o uso duplo.)
Os cigarros eletrônicos não são “95% menos prejudiciais que os cigarros”. Essa afirmação frequentemente citada é indefensável porque o vaping tem sido associado a muitos casos de danos pulmonares agudos, eventos não observados em fumantes. Cerca de 80% desses casos estão relacionados ao uso de líquidos com canabinóides, mas 20% não. Se os efeitos agudos do vaping são piores do que os do tabaco, como alguém pode afirmar seriamente que os efeitos de longo prazo desconhecidos, são menos prejudiciais e esperar que acreditem?
Os cigarros eletrônicos são potentes gatilhos de inflamação das vias aéreas, o que leva a efeitos respiratórios adversos. Eles contêm toxicidades que se sobrepõem às do tabaco, além de toxicidades únicas. Atualmente, não podemos quantificar os danos associados e traduzir esses efeitos em números futuros de pacientes doentes, mas isso não justifica a imposição de danos.
Além disso, o uso generalizado de cigarros eletrônicos, traz um risco social substancial de aceitação do vício. Esta aceitação será, sem dúvida, aumentada com o licenciamento de cigarros eletrônicos para uso medicinal. Os cigarros eletrônicos, assim como outros produtos aquecidos de liberação de nicotina, são comercializados usando as mesmas artes sombrias usadas para cigarros. Uma vez que os adolescentes estão vaporizando, eles têm um risco seis vezes maior de se tornarem fumantes.
Muitos cigarros eletrônicos são produzidos e comercializado por empresas pertencentes à indústria do tabaco, uma indústria com um histórico de mentir para o público e gastar fortunas em marketing, inclusive para adolescentes. Devemos proteger crianças e adolescentes desses marqueteiros cínicos, e permitir que eles sejam a primeira geração em um século não viciada em nicotina.
Efeitos a longo prazo desconhecidos
Por que os médicos querem participar da aprovação dos cigarros eletrônicos? Nenhum outro “tratamento” seria aceito com o nível atual de evidência, e a maioria dos médicos estaria violando, pelo menos sua própria consciência, ao prescrever qualquer coisa com efeitos adversos de longo prazo prováveis, mas desconhecidos. Disfarçar os cigarros eletrônicos, como uma estratégia sensata de redução de danos, corre o risco de enfraquecer as estratégias sustentáveis de cessação do tabagismo.
Em vez disso, os médicos devem ajudar a reviver um serviço de cessação do tabagismo decente financiado pelo NHS, pressionar os políticos para aumentar os impostos sobre os produtos que contêm nicotina, e restringir ainda mais o tabagismo, bem como o vaping. A Grã-Bretanha tem uma longa tradição de liderança na prevenção do tabagismo. Aumentar esses esforços e distanciar-se de uma indústria que promove o vício, tornaria novamente o país um portador da tocha na prevenção do tabagismo, em vez de exibir um exemplo tolo de excepcionalismo britânico.


Sobre a “polemização” da vacina da Covid-19 em crianças de 5 a 11 anos
O Comitê Extraordinário de Monitoramento da Covid-19 da Associação Médica Brasileira, CEM COVID_AMB, considera inaceitável e absolutamente inadequada a “polemização” incentivada por algumas pessoas sobre a vacina Covid em crianças de 5 a 11 anos.
Fartas evidências científicas comprovam a segurança e a eficácia da imunização nesse público específico. Imunização, aliás, já adotada com sucesso em diversos países do mundo.
É igualmente um desserviço do ponto de vista humano. O Brasil perde tempo na luta contra a Covid (mais uma vez), expõe as futuras gerações a riscos evitáveis e gera insegurança entre os cidadãos, entre outros problemas. Isso em virtude de uma polêmica infundada, negacionista à Ciência, e irresponsável socialmente.
Faz cerca de um mês que se alonga um protelamento infrutífero, contraproducente e desnecessário, período durante o qual já poderíamos ter adiantado o processo vacinal das crianças, para um retorno mais tranquilo às atividades escolares inclusive.
É lamentável ver alguns agentes públicos alardeando que não vacinarão seus filhos, enquanto outros deixam de assumir suas responsabilidades por questões que, certamente, fogem do foco prioritário: o bem-estar e a saúde dos brasileiros.
São Paulo, 4 de janeiro de 2022.

Caro (a) Amigo (a),
Eu desejo ao prezado amigo
Que tenha um Natal de paz
Com toda a família reunida
E cada sonho se torne capaz
Não deixe nada para depois
E já em dois mil e vinte e dois
Seja abençoado cada vez mais.

Na dúvida, procure um especialista... existe o PCR para a Covid-19, mas existe também um painel de PCR para outros vírus respiratórios, incluindo a Influenza...

Estudo de acompanhamento em pacientes infectados pela COVID-19, relacionados com a função pulmonar, tomografia computadorizada do tórax e outras características fisiológicas relacionadas.
Artigo publicado na Nature em 05/07/2021, onde pesquisadores chineses mostram a evolução da doença pulmonar na Covid-19 após 8 meses da infecção inicial, tanto do ponto de vista radiológico, quanto do ponto de vista da função pulmonar. Portanto, o acompanhamento regular é necessário, para avaliar os déficits pulmonares residuais.
Introdução
A doença por coronavírus 2019 (COVID-19) é uma doença infecciosa recentemente emergida, causada pela síndrome respiratória aguda grave do coronavírus 2 (SARS-CoV-2). Em 31 de dezembro de 2020, 81.475.053 casos confirmados acumulados e 1.798.050 mortes confirmadas, foram relatados globalmente. Durante o período do surto, os pesquisadores se concentram principalmente nas características epidemiológicas, infecção e mecanismos fisiopatológicos, bem como métodos de tratamento desta doença. Estudos anteriores mostraram que a COVID-19 envolve vários órgãos e o pulmão é um dos órgãos mais importantes envolvidos.
Entre os pacientes com COVID-19, cerca de 14% dos casos foram graves e 5% dos casos foram críticos, e a taxa geral de letalidade (CFR) foi de 5,0% (4788 mortes totais/96.673 casos confirmados totais) na China, com base em dados até a 31 de dezembro de 2020, do Centro Chinês para Controle e Prevenção de Doenças. Embora a CFR geral de COVID-19 seja inferior ao da síndrome respiratória aguda grave (SARS de 9,6%) e da síndrome respiratória do Oriente Médio (MERS de 34,4%), alterações radiológicas e anormalidades da função pulmonar, podem ser encontradas em uma proporção considerável de sobreviventes de COVID-19 no momento da alta hospitalar, na fase de convalescença precoce, e mesmo em 3 e 6 meses após a alta hospitalar.
Os pacientes graves tiveram uma maior redução na capacidade de difusão do pulmão de monóxido de carbono (CDCO) e encontrou maior diminuição da capacidade pulmonar total (CPT) e diminuição da distância percorrida em seis minutos (TC6) em comparação com pacientes não graves, 30 dias após a alta. Apesar disso, ainda há pouca evidência clínica para o acompanhamento a longo prazo da função pulmonar, e do distúrbio fisiológico em pacientes com COVID-19 grave.
Assim, foram coletados e analisados retrospectivamente os dados clínicos durante a hospitalização, e 8 meses após a alta hospitalar, para investigar o impacto a longo prazo da COVID-19 grave na função pulmonar, nas imagens de tomografia computadorizada de alta resolução (TCAR) de tórax e nas características fisiológicas relacionadas. Para tentar se descobrir os fatores de risco potenciais.
Resultados
Características dos pacientes envolvidos
Recrutamos 21 mulheres e 19 homens com idade média de 57 (40-68) anos e uma média do índice de massa corporal (IMC) de 25,47 ± 4,22 kg/m2, incluindo 25 casos graves. As comorbidades comuns incluíram hipertensão (18 casos, 45,0%), diabetes mellitus (6 casos, 15,0%), doença cardíaca coronária (4 casos, 10,0%), doença pulmonar obstrutiva crônica (DPOC) (2 casos, 5,0%) e asma (2 casos, 2,5%). 8 ou 20,0% pacientes eram fumantes, mas apenas 1 era fumante atual na admissão. Durante o período de COVID-19, 32 (80,0%) pacientes receberam tratamento com oxigênio e 2 deles necessitaram de tratamento adicional de ventilação não invasiva com pressão positiva (VNIPP) e admissão na UTI; 24 (60,0%) pacientes receberam glicocorticoides e 5 deles necessitaram de glicocorticoides em altas doses.
O seguimento foi obtido em média de 249 ± 15 dias após a alta. Aos 8 meses, 22 pacientes (55,0%) ainda apresentavam sintomas físicos e/ou psicológicos persistentes, e 9 pacientes (22,5%) ainda sofriam de diferentes graus de limitações na vida diária. Embora todos os pacientes apresentassem CVF normal, 1 (2,5%), 13 (32,5%) e 9 pacientes (22,5%) apresentavam CPT, CDCO e CDCO/VA abaixo de 80% dos valores previstos, respectivamente. 8 pacientes (20,0%) apresentavam VEF1/CVF abaixo de 70% dos valores previstos, sendo que 2 deles tinham história de DPOC com história significativa de tabagismo, os outros 6 não tinham história de DPOC, asma ou tabagismo. 22 pacientes (55,0%) apresentavam pelo menos dois dos três índices de MEF50, MEF25 e MMEF75/25 abaixo de 65% dos valores previstos, o que indica disfunção das pequenas vias aéreas.
A TCAR de tórax de 28 pacientes (70,0%) era normal ou basicamente normal (escore de TC < 5), enquanto os 12 pacientes restantes, apresentavam TC anormal 8 meses após a alta. No entanto, as anormalidades da TC e os comprometimentos da função pulmonar não foram completamente consistentes em todos os pacientes. As imagens de TC de acompanhamento de 2 pacientes com COVID-19 grave com TC anormal, mas com status de função de difusão pulmonar diferente, 8 meses após a alta, são apresentadas na Fig. 1.

TCAR seriadas de 2 COVID-19 graves com diferentes status da capacidade de difusão do monóxido de carbono:
(a – d) TCAR em série de uma paciente COVID-19 de 65 anos com CDCO normal em oito meses após a alta
(e – h) TCAR em série de uma paciente COVID-19 de 71 anos com CDCO anormal em oito meses após a alta.
Os padrões de TC anormais mais comuns foram opacidade em vidro fosco (21 casos, 52,5 %), linhas irregulares (19 casos, 47,5%), linha subpleural (2 casos, 5,0%) e padrão reticular (2 casos, 5,0%), são apresentadas na Fig. 2.

Padrões anormais de TCAR de paciente com COVID-19 grave no acompanhamento de oito meses após a alta.
Os padrões anormais de TCAR são indicados por setas:
(a) opacidades em vidro fosco
(b) linhas irregulares
(c) linha subpleural
(d) padrão reticular, que ainda pode ser visto em alguns dos pacientes COVID-19 em convalescença de oito meses após a alta.
Análises de subgrupos
Os pacientes foram divididos em dois grupos de acordo com a gravidade de COVID-19:
Em comparação com os casos leves, os casos graves tiveram maior pontuação no escore da TCAR, maior taxa de tratamento com oxigênio, mais dias cumulativos de tratamento com oxigênio, maior concentração máxima de oxigênio inalado, e mais dias cumulativos de recebimento de glicocorticoides durante a hospitalização, uma tendência de maior taxa de recebimento de glicocorticoides e uma tendência de maior dosagem total de glicocorticóides usados durante a hospitalização.
Aos 8 meses após a alta, mais pacientes no grupo de casos graves apresentavam sintomas físicos e/ou psicológicos persistentes. Casos graves tiveram maior pontuação no questionário de sintomas, maior redução na taxa de CDCO, maior taxa de disfunção das pequenas vias aéreas, menor VEF1% previsto, menor CVF% previsto, menor MEF50% previsto, menor MVV% previsto, maior Z a 5 Hz% previsto, que indicou maior impedância respiratória total, maior R periférica, que indicou maior resistência nas vias aéreas periféricas, menor CDCO% previsto e maior escore na TCAR, quando em comparação aos casos leves.
Os pacientes foram divididos em dois grupos de acordo com a pontuação da TCAR no acompanhamento:
Em comparação com pacientes com TC normal ou basicamente normal (pontuação de TC <5) em oito meses, os pacientes com TC anormal (pontuação de TC ≥ 5) apresentaram maior pontuação de pico de TC, contagem de linfócitos mais baixa, maior nível de procalcitonina, maior nível de lactato desidrogenase (LDH), maior nível de D dímero, menor nível de albumina, maior nível de aspartato aminotransferase (TGO ), mais dias cumulativos de tratamento com oxigênio, maior concentração máxima de oxigênio inalado, mais dias cumulativos de recebimento de glicocorticóides e dosagem total mais alta de glicocorticóides usados durante a internação.
8 meses após a alta, os pacientes com TC anormal, tinham IMC mais alto, % de CPT prevista menor, % de VR normal previsto menor e maior taxa de CDCO anormal. Para padrões anormais de TC, os pacientes com TC anormal eram mais propensos a ter vidro fosco residual e linhas irregulares.
Os pacientes foram divididos em dois grupos de acordo com a CDCO no acompanhamento
Em comparação com pacientes com CDCO normal em 8 meses, os pacientes com CDCO anormal tiveram mais dias cumulativos de tratamento com oxigênio, maior taxa de recebimento de glicocorticoides, mais dias cumulativos de recebimento de glicocorticoides e maior dosagem total de glicocorticoide utilizada durante a internação. 8 meses após a alta, os pacientes com CDCO anormal, apresentaram maior pontuação no escore da TCAR e menor VVM% previsto.
De acordo com CDCO e CDCO/VA, os pacientes foram categorizados como grupo A com CDCO ≥ 80% do previsto, grupo B com CDCO < 80% do previsto, mas CDCO/VA ≥ 80% do previsto e grupo C com CDCO e CDCO/VA < 80% do previsto. Os níveis séricos de interleucina (IL) -2R, IL-8 e fator de necrose tumoral (TNF) -α, durante a hospitalização em pacientes do grupo C, foram os mais baixos entre os 3 grupos. A CPT% previsto e o VR% previsto no grupo B foram menores que os dos outros 2 grupos. Os pacientes do grupo B apresentaram menor X em 5 Hz [- 0,08 ± 0,04 (grupo A) versus - 0,10 ± 0,02 (grupo B) versus - 0,05 ± 0,03 (grupo C)], o que indicou maior recuo elástico das vias aéreas periféricas, respectivamente.
Associação entre padrões anormais de TCAR e maiores e mais graves sintomas
Para encontrar padrões específicos de TCAR anormais associados a piores sintomas, os pacientes foram divididos em 2 grupos de acordo com o grau da escala de status funcional pós-COVID-19 (PCFS). No entanto, independentemente de o valor de corte do agrupamento ter sido definido, como grau da escala PCFS ≥ 1 ou 2, não houve diferença significativa nos padrões anormais de TCAR, 8 meses após a alta entre os dois grupos.
Análises de correlação
Em seguida, foram analisadas as correlações entre os dados clínicos durante o período com a COVID-19, com a função pulmonar, com o escore da TCAR e com características fisiológicas relacionadas no acompanhamento.
A pontuação da TCAR após a alta foi positivamente correlacionada com a idade, com o IMC, com a pontuação de pico da TCAR, com o nível da Procalcitonina, com o nível de LDH, com o nível do D dímero, com os dias cumulativos de tratamento com oxigênio, com a concentração máxima de oxigênio inalado, com os dias cumulativos de recebimento de glicocorticóides e com a dosagem total de glicocorticóides usada durante a hospitalização; e negativamente correlacionado com a contagem baixa de linfócitos e baixa do nível de albumina durante a hospitalização.
O CDCO% dos valores previstos foi negativamente correlacionado com dias cumulativos de tratamento com oxigênio. O CDCO/VA% dos valores previstos correlacionou-se positivamente com o IMC e com o nível sérico de TNF-α durante a hospitalização. A TC6’ foi negativamente correlacionada com a idade, com o IMC e com o nível sérico de Procalcitonina, com os dias cumulativos de tratamento com oxigênio e com a concentração máxima de oxigênio inalado durante a hospitalização.
Análises de regressão logística
Com base em análises uni variadas, as variáveis com diferenças significativas entre os pacientes com TCAR normal e anormal, ou a CDCO, foram posteriormente analisadas por análises de regressão logística usando o método forward: LR. Verificou-se que o aumento da pontuação de pico na TCAR durante a hospitalização, foi o fator de risco independente associado à TCAR anormal, em oito meses após a alta, e dias cumulativos mais longos com o tratamento com oxigênio, foi associado a CDCO anormal oito meses após a alta.
Discussão
Desde dezembro de 2019, um novo coronavírus, agora denominado SARS-CoV-2, causou uma pandemia global de COVID-19. Embora a maioria das pessoas infectadas sejam pacientes assintomáticos ou leves, a COVID-19 tem gerado grande número de casos graves, devido ao grande número de casos confirmados. De acordo com relatos anteriores, anomalias da ventilação pulmonar e da capacidade de difusão, foram observadas em uma proporção considerável de pacientes com a COVID-19, no momento da alta hospitalar, especialmente em pacientes com doença grave.
30 dias após a alta, os pacientes graves ainda apresentavam maior incidência de comprometimento da CDCO e menor CPT, em comparação com pacientes não graves, o que indica que os pacientes graves podem precisar de mais tempo para se recuperar, e que são necessários mais estudos de acompanhamento prolongado.
3 meses após a alta, 39 pacientes (70,9%) ainda apresentavam manifestação tomográfica anormal e 9 pacientes (16,4%) tinham CDCO prejudicada, mas apenas 4 casos graves foram incluídos neste estudo. Em um novo estudo, 25 casos graves foram incluídos, e em uma proporção considerável (48%) dos pacientes com COVID-19 grave, ainda apresentavam anormalidades na CDCO, 8 meses após a alta. A proporção foi maior do que a dos pacientes na escala de gravidade 4 (29%), mas menor do que na dos pacientes na escala de gravidade 5–6 (56%) relatada por Cao e colegas, 6 meses após a alta.
A pontuação média da TCAR dos casos graves foi 3, 8 meses após a alta, que foi maior do que nos casos leves. Apenas 4 pacientes graves com COVID-19 (16%) apresentaram TCAR completamente normal, proporção inferior a 29,1% relatada por Zhao e colegas, 3 meses após a alta. 10 pacientes com COVID-19 grave (40%), ainda apresentavam pontuação de TCAR anormal acima de 5. Até onde se sabe, este é o primeiro estudo que relatou a proporção de pacientes com TCAR anormal em casos de COVID-19 grave, mais de 6 meses após a alta.
Mesmo 8 meses após a alta, os casos graves ainda apresentavam maior incidência de comprometimento da CDCO e menor CPT, em comparação com pacientes leves. Para todos os pacientes, os pacientes com TCAR anormal tiveram menor CPT% previsto, menos RV% previsto, maior taxa de CDCO anormal e uma tendência de menor distância percorrida no TC6’, indicando que esse tipo de paciente pode ter disfunção ventilatória restritiva potencial, comprometimento da função de difusão pulmonar e baixa tolerância ao exercício.
Imagens de pneumonia viral, são a característica mais comum da TCAR de tórax, em pacientes com COVID-19, principalmente presentes como opacidades em vidro fosco e opacidades pulmonares consolidativas, tão semelhantes como na SARS e MERS. No entanto, as lesões da COVID-19, têm maior probabilidade de impactar nos pulmões bilaterais e em lobos múltiplos, do que as de SARS.
Estudos anteriores relataram, que a SARS tem efeitos de longo prazo sobre a função pulmonar, sobre a tomografias computadorizadas de tórax e nas características fisiológicas relacionadas, em parte dos sobreviventes, mesmo 1 ano após a alta.
No atual estudo, 2 dos casos graves receberam terapia com N-acetilcisteína (NAC) após a alta hospitalar. Um deles foi tratado com NAC por 2 semanas após a alta, outro paciente recebeu NAC de longo prazo e corticosteroides inalatórios, combinados com terapia β-agonistas de longa duração (ICS/LABA) devido à comorbidade com DPOC. Um paciente com COVID-19 grave recebeu terapia de longo prazo com ICS/LABA devido à comorbidade com asma, e estava planejando receber terapia com pirfenidona, devido à manifestação anormal residual na TCAR, uma CDCO anormal e uma CDCO/VA anormal.
Evidências demonstraram a eficácia do corticosteroide, na redução da mortalidade em 28 dias em pacientes gravemente enfermos com COVID-19. No entanto, nenhuma evidência atualmente apoia ou refuta os benefícios dos corticosteroides ou agentes antifibróticos, para pacientes com sintomas persistentes ou TCAR ou CDCO anormais. A eficácia do agente antifibrótico, como a pirfenidona, em pacientes com COVID-19 é especulada principalmente, com base no mecanismo farmacológico e na fisiopatologia da COVID-19.
Ao contrário da fibrose pulmonar idiopática (FPI), ou na fibrose pulmonar secundária a causas autoimunes, a fibrose observada em alguns sobreviventes de COVID-19, pode não ser progressiva. Portanto, o acompanhamento regular para avaliar os déficits pulmonares residuais, e a confirmação da fibrose é essencial, para determinar a necessidade de tratamento antifibrótico.
Mesmo 12 casos (48%) graves neste estudo, ainda apresentavam CDCO anormal em mais de 6 meses após a alta, cuja proporção foi inferior a 76,5% relatada por Huang e colegas, em casos graves em 30 dias após a alta, e outros índices de função pulmonar, como CVF e CPT, tiveram as mesmas tendências. Esses resultados indicaram que a lesão pulmonar causada pelo COVID-19 em casos graves, pode ter capacidade de auto reabilitação, semelhante à SARS.
No entanto, o processo de reabilitação de pacientes com diferentes gravidades foi variável. Mesmo para 2 casos graves tratados com Ventilação Não Invasiva e internação na UTI, 1 deles apresentava TCAR e CDCO basicamente normais, o outro apresentava TCAR e CDCO anormais, 8 meses após a alta. O mecanismo sublinhado ainda não é bem conhecido. Como mostrado em nossos resultados, em comparação com pacientes com TCAR normal ou quase normal, os pacientes com TCAR anormal tiveram maior pontuação de pico na TCAR, maior nível de Procalcitonina, maior nível de LDH, maior nível de TGO e dias cumulativos mais longos de tratamento com glicocorticoides e oxigênio.
As análises de correlação indicaram, que os escores da TCAR após a alta, foram positivamente correlacionados com a idade. A CDCO% prevista foi negativamente correlacionada com dias cumulativos de tratamento com oxigênio. As análises de regressão logística indicaram que o aumento da pontuação de pico da TCAR, foi o fator de risco independente associado à TCAR anormal residual, e dias cumulativos mais longos de tratamento com oxigênio, foram associados a CDCO anormal no acompanhamento. Esses resultados indicaram que a COVID-19 teve um impacto maior a longo prazo na fisiologia pulmonar de pacientes que eram mais velhos, mais graves e mais complicados na fase aguda.
Curiosamente, a correlação do IMC com as anormalidades da TCAR e a capacidade de difusão pulmonar no acompanhamento, não foi consistente. Pacientes com TCAR anormal tiveram IMC mais alto, e o IMC se correlacionou positivamente com o escore de TCAR, consistente com o achado de que pacientes obesos, têm maior probabilidade de desenvolver COVID-19 grave. O IMC correlacionou-se positivamente com CDCO/VA% previsto, e teve uma tendência de correlação positiva com CDCO% prevista após a alta neste estudo.
Em estudos anteriores, a relação entre o IMC com a capacidade de difusão pulmonar e fibrose pulmonar, não foi suficientemente compreendida. Um estudo com afro-americanos, sem doença cardiopulmonar ou da parede torácica, mostrou que o IMC se correlacionou negativamente com a CDCO.
Outro estudo em pacientes com DPOC da China mostrou, que o IMC foi positivamente correlacionado com a CDCO e CDCO/VA. Uma série de estudos clínicos sobre FPI mostrou, que um IMC mais baixo, está associada a um pior resultado de FPI, mas índices da capacidade de difusão pulmonar não foram observados nestes estudos.
Especula-se que um melhor estado nutricional, pode promover a recuperação da lesão pulmonar na COVID-19 grave, uma vez que o IMC pode ser considerado um indicador de nutrição.
Surpreendentemente, 6 pacientes (15%) sem anormalidades óbvias na TCAR, também apresentaram uma CDCO anormal. Acredita-se que esse fenômeno possa ser causado pela formação de microtrombos, o que foi confirmado pelos achados da autópsia, em pacientes que morreram de COVID-19. A outra opção, é que eles já poderiam ter uma CDCO anormal, antes da doença COVID-19.
A CDCO pode não refletir suficientemente a capacidade de troca gasosa. ENTÃO, dividiram-se os pacientes em 3 grupos de acordo com CDCO e CDCO/VA. os pacientes com CDCO anormal, mas CDCO/VA normal, tiveram o menor CPT% prevista e VR% previsto, marcadores de disfunção da ventilação restritiva, indicando que, para este grupo de pacientes, a diminuição da CDCO foi causada principalmente pela redução do volume alveolar. Mas anormalidades pulmonares intersticiais ou vasculares, causadas por COVID-19, também podem existir e contribuir para a anormalidade da CDCO em pacientes com CDCO anormal, mas CDCO/VA normal, porque este grupo de pacientes teve uma tendência de menor CDCO/VA, em comparação com pacientes com CDCO normal.
Surpreendentemente, observou-se que os pacientes com CDCO e CDCO/VA anormais, tinham níveis séricos mais baixos de IL-2R, IL-8 e TNF-α, em comparação com os outros 2 grupos, embora a diferença fosse apenas significativa, em comparação com pacientes com CDCO anormal, mas CDCO/VA normal. As análises de correlação indicaram, que CDCO/VA% dos valores previstos, foi positivamente correlacionado com o nível sérico de IL-2R e TNF-α, e teve uma tendência de correlação positiva com o nível sérico de IL-6. Estudos anteriores indicaram, que a tempestade de citocinas pode contribuir para a gravidade e mortalidade na COVID-19.
Por outro lado, um estudo anterior havia demonstrado que a inflamação pode ser uma faca de dois gumes: a inflamação desempenha um papel essencial na eliminação viral, e no início do processo de reparo, mas a hiperinflamação pode levar a lesões de órgãos, e à gravidade da doença. De acordo com os resultados deste estudo, especula-se que tanto a hiperinflamação, quanto a ausência de inflamação, podem levar ao comprometimento da capacidade de difusão pulmonar, na fase de recuperação do COVID-19.
Digno de nota, apenas 40 pacientes foram recrutados. Um número limitado de casos pode levar a resultados tendenciosos, especialmente naqueles com forte subjetividade, como o SF-36. O tamanho limitado da amostra, também pode se levar a não se ser capaz de encontrar padrões de TCAR anormais específicas, associadas a piores sintomas e redução na CDCO no acompanhamento, embora os resultados indicassem, que a TCAR anormal estava relacionada a CDCO anormal.
Também se observou, que a função pulmonar e a TCAR de tórax, antes da infecção por SARS-CoV-2, não eram conhecidas, o que torna inadequado atribuir simplesmente uma função pulmonar anormal e/ou tomografias computadorizadas alteradas, à COVID-19.
Finalmente, pacientes assintomáticos e pacientes com intubação não foram incluídos, e apenas 2 pacientes que necessitaram de tratamento com VNI adicional, foram incluídos neste estudo. O impacto a longo prazo da COVID-19 em casos assintomáticos e gravemente enfermos, não pôde ser concluído neste estudo.
Conclusões
Em conclusão, o estudo demonstrou que os sobreviventes com a COVID-19 grave tiveram maiores incidências de comprometimento da CDCO, sintomas persistentes na vida diária, e maior pontuação tomográfica anormal, em comparação com casos leves. A anormalidade radiológica de longo prazo pode estar relacionada à idade avançada e à gravidade da COVID-19. A ausência ou excesso de reação inflamatória durante o curso de COVID-19, levaria ao comprometimento da capacidade de difusão pulmonar na fase de recuperação.

A pandemia da COVID-19 deve levar a vacinas contra tuberculose
Editorial publicado na Nature em 27/10/2021, onde os editores comentam que a crise do coronavírus interrompeu décadas de progresso na tuberculose. Mas a velocidade das vacinas contra a COVID-19 mostra que ainda pode haver esperança de avanços contra outras doenças negligenciadas.
Pesquisadores e médicos estão chateados e frustrados, pelo fato de décadas de trabalho no diagnóstico, tratamento e pesquisa da tuberculose (TB) terem sidos paralisados enormemente. A desaceleração significa que o mundo está perdendo terreno contra uma doença, que mata 1,5 milhão de pessoas todos os anos.
Enquanto a União Internacional Contra a Tuberculose e Doenças Pulmonares, realizava sua conferência anual online na semana passada, o Dr. Guy Marks, falou por muitos quando, comparando os esforços contra o COVID-19, disse: “Muitos de nós que trabalhamos contra a tuberculose no campo nos sentimos roubados, porque esforços equivalentes para desenvolver uma vacina contra a tuberculose, nunca foram tão bem comprometidos ou financiados.”
Dr. Marks acrescentou: “O não fornecimento de vacinas contra a COVID-19, para países de baixa e média renda, e o fim da tuberculose, são as duas faces da mesma moeda, uma desvalorização da vida humana nos países pobres.” Ele tem razão. Mas não precisa ser assim.
Os pesquisadores estão novamente conclamando, os tomadores de decisão a retomarem a iniciativa nos programas de pesquisa para a tuberculose e outras doenças infecciosas, como a malária. E eles estão dizendo que muito pode ser aprendido depois que a criação das vacinas COVID-19 foi realizada.
Os pesquisadores têm alertado, que ainda mais pessoas morrerão de tuberculose e outras doenças infecciosas, como malária e HIV, se os sistemas de saúde continuarem a negligenciar essas infecções por causa do foco contínuo apenas no coronavírus. E eles estão implorando aos financiadores e aos governos, que não deixem cair a bola no trabalho da tuberculose.
Mas seus avisos não estão sendo ouvidos. Não apenas mais pessoas estão morrendo da doença, mas também a meta de reduzir as mortes em 90%, em relação aos níveis de 2015 até 2030, parte dos Objetivos de Desenvolvimento Sustentável das Nações Unidas, está agora em perigo. De acordo com a pesquisa publicada este mês, essa falha também levará a profundas perdas econômicas e de saúde na casa dos trilhões de dólares, com um maior impacto na África Subsaariana.
Um problema crucial, é que menos profissionais médicos estão disponíveis para diagnosticar e tratar a tuberculose. Como resultado, o número de pessoas diagnosticadas com a doença, caiu de 7,1 milhões em 2019 para 5,8 milhões em 2020. Índia, Indonésia e Filipinas são os países mais afetados, de acordo com o último relatório de TB da Organização Mundial da Saúde (OMS), publicado este mês.
Ao mesmo tempo, o financiamento também diminuiu. Os gastos globais com serviços de diagnóstico, tratamento e prevenção da tuberculose, caíram de US $ 5,8 bilhões para US $ 5,3 bilhões em 2020. Além disso, esse gasto geral é menos da metade da meta global da OMS, de US $ 13 bilhões anuais até 2022. O financiamento da pesquisa da tuberculose também é metade do que precisa ser. A OMS definiu uma meta separada para isso de US $ 2 bilhões anuais para 2018 a 22. Em 2019, o financiamento para pesquisas sobre TB, totalizou apenas US $ 901 milhões. Em contraste, apenas os Institutos Nacionais de Saúde dos EUA, reservaram US $ 4,9 bilhões para pesquisas sobre COVID-19. A pesquisa publicada em TB parece estar se segurando por enquanto, de acordo com uma análise publicada esta semana no Nature Index.
Alguns delegados da conferência, falaram em reduzir as metas de diagnóstico e tratamento da tuberculose e de outras doenças infecciosas, para levar em conta essas e outras realidades básicas. Mas isso seria desaconselhável. Embora a pandemia de COVID-19 seja a maior prioridade para líderes políticos, nações mais ricas e doadores filantrópicos, a pandemia também mostrou como é possível impulsionar tanto a pesquisa sobre uma doença infecciosa, quanto o tratamento, e como fazê-lo com rapidez, o que levou às vacinas contra a COVID-19 em tempo recorde.
As lições da COVID-19 devem ser aplicadas na luta contra a tuberculose e outras doenças infecciosas, desde a mobilização de recursos extraordinários até o uso de tecnologias emergentes, como o RNA mensageiro e outras plataformas para criar vacinas. Avanços em diagnósticos rápidos e confiáveis, computação avançada, sequenciamento e capacidade de ensaios clínicos para novas vacinas e tratamentos, podem ser aproveitados para TB e outras doenças infecciosas.
A vacina contra TB em uso hoje é essencialmente a mesma que a vacina Bacillus Calmette-Guérin (BCG) introduzida em julho de 1921.
A pandemia de COVID-19 mostrou que é possível produzir novas vacinas em um ano, não 100, desde que haja financiamento e vontade política.

O absurdo de envelhecer ter se tornado doença para a OMS
Comentário publicado na Diário do Nordeste em 25/10/2021, onde o psicoterapeuta Antonio Trajano comenta que essa distorção tem como objetivo institucionalizar a doença e, consequentemente suas “drogas curativas”
Quero comunicar a vocês que em 1º de janeiro serei considerado doente! Já tenho até o código (GM2A) da minha doença, olha só!
Como assim? É que a partir de 1º de janeiro de 2022 a velhice constará na Classificação Internacional de Doenças e Problemas Relacionados a Saúde (CID) da organização Mundial de Saúde.
Atualmente, os idosos já sofrem muitos preconceitos. É que chamamos de idadismo ou etarismo. Isso é real e gritante.
Por não atenderem, ou corresponderem, aos padrões de exigência da sociedade de performance que vivemos, são excluídos nas mais diversas esferas da vida. Excluídos por não terem a mais bela aparência, por não terem a melhor agilidade, por não serem mais tão produtivos, por estarem mais susceptíveis e se mostrarem com alguma dor e sofrimento.
Essa etapa da vida é caracterizada pelas perdas. A perda do cônjuge, perda de uma maior convivência com outros membros da família, perda dos amigos, perda do trabalho, perda da vida social.
No aspecto trabalho, as empresas tenderão a colocar obstáculos em contratar um funcionário que teria que ser admitido já com uma “doença”. Essa “seleção” que estão tentando naturalizar gerará sofrimento aos afetados em questão.
Nesse caso, como seriam os critérios para uma licença por motivo de doença, se ele já “está” doente? Seria afastado para ser pago pelo INSS?
Sabemos que essa preterição frustra e entristece, deixando-o infeliz, podendo inclusive, desembocar em uma depressão.
Segundo a Pesquisa Nacional de Saúde, realizada pelo IBGE em 2019, os idosos lideram o ranking dos mais afetados pela depressão. E é também dos idosos os maiores índices de suicídio.
Numa cultura como a nossa que não valoriza a experiência que o idoso tem, aliado as inúmeras perdas que ele sofre, inevitavelmente compromete sua saúde emocional.
Isso faz com que muitos indivíduos dessa faixa etária percam o amor pela vida e se abandonem na estagnação física e mental. Sem o poder de decidir, sem reconhecimento e sem um “lugar” no mundo, tendem a fugir e se isolar dos conhecidos, as vezes de seus próprios familiares.
Segundo o executivo e colunista Henrique Noya, no site MedicinaS/A, a justificativa da OMS seria uma forma para reconhecer que as pessoas podem morrer de velhice. Um exemplo seria do Príncipe Philip, esposo da rainha da Inglaterra que morreu aos 99 anos. A causa da morte, segundo o atestado de óbito, foi “idade avançada”.
Segundo a mesma matéria, essa inclusão seria do interesse de empresas ligadas a longevidade, que com inclusão da “doença” velhice, aumentaria sobremaneira o número de casos. E justificaria o aumento de financiamentos para pesquisas na área, em busca de remédios e da “cura”.
Mas, como conceituar e definir uma cura se estamos falando de uma etapa natural do desenvolvimento humano? Essa distorção tem como objetivo institucionalizar a doença. E, consequentemente suas “drogas curativas”, gerando lucros financeiros para quem as produz.
Investir em uma melhor qualidade de vida é prevenção para uma longevidade saudável. Não adianta simplesmente aumentar o número de anos de vida do indivíduo se ele não terá qualidade e autonomia para que viva dignamente.
Paz e bem!

Doença do refluxo gastroesofágico (DRGE)- ARTIGO DE REVISÃO
Introdução
A doença do refluxo gastroesofágico (DRGE) é definida por seus sintomas cardinais (queimações recorrentes e dolorosas e regurgitação) ou por suas complicações específicas (esofagite, estenoses pépticas e esôfago de Barrett).
Diretrizes do Colégio Americano de Gastroenterologia define doença do refluxo gastroesofágico (DRGE) como “sintomas ou complicações resultantes do refluxo do conteúdo gástrico no esôfago ou além, na cavidade oral (incluindo laringe) ou pulmão”. Esofagite erosiva (EE), doença não-erosiva do refluxo (NERD) e o esôfago de Barrett, são as três apresentações fenotípicas da DRGE. Em geral, os pacientes tendem a permanecer dentro de sua apresentação fenotípica ao longo da vida, com muita pouca progressão ou regressão. A doença do refluxo gastroesofágico (DRGE) afeta a 20% da população ocidental. Os principais sintomas da DRGE são azia e regurgitação. No entanto, a DRGE pode apresentar uma variedade de outros sintomas, incluindo dor no peito ou desconforto, disfagia, arrotos, dor epigástrica, náusea e inchaço.
O esôfago de Barrett é uma metaplasia colunar que substitui partes do epitélio de células escamosas nativas, que podem progredir para adenocarcinoma esofágico. A DRGE pode ser um problema sério e não deve ser confundida com doenças menos graves, como gastrite ou os sintomas muito comuns de dispepsia ou regurgitação, que ocorrem em quase todos os indivíduos sem qualquer patologia gastrointestinal subjacente.
A DRGE é causada pelo conteúdo gástrico que atinge o esôfago. Exceto por causar sintomas ou complicações esofágicas, os sucos gástricos também podem atingir mais proximalmente (ou seja, na faringe, boca, laringe e vias aéreas), e causar ou piorar vários sintomas e condições extra esofágicas, como rouquidão, sibilância, tosse e asma. Fatores de risco estabelecidos para o desenvolvimento de DRGE, incluem aumento do índice de massa corporal, tabagismo e predisposição genética, enquanto a infecção com a bactéria gástrica Helicobacter pylori, pode diminuir esse risco.
A prevalência de DRGE é alta e crescente, com taxas maiores em países de alta renda (15% a 25%) do que na maioria dos países de baixa e média renda (< 10%). A DRGE pode resultar em diminuição da qualidade de vida relacionada à saúde, e sua prevalência e necessidade de tratamento de longo prazo, podem consumir recursos substanciais de saúde, e resultar em altos custos para a sociedade.
A prevalência de DRGE depende da idade. Quase 50% dos recém-nascidos regurgitam ou vomitam diariamente, mas isso se resolve espontaneamente em 90% das crianças com 1 ano de idade. Em adultos, a prevalência aumenta ainda mais com a idade, com uma prevalência de 14,0% entre indivíduos com menos de 50 anos e 17,3% entre aqueles com 50 anos ou mais.
Fisiopatologia
O esôfago é o tubo muscular que conecta a boca ao estômago. No estômago, o ácido é produzido para ajudar na digestão dos alimentos. Se o conteúdo ácido do estômago atinge o esôfago, pode causar sintomas persistentes e incômodos ou complicações específicas, conhecidas como doença do refluxo gastroesofágico (DRGE). A DRGE é uma das doenças mais comuns, e estima-se que aproximadamente 20% da população adulta do mundo ocidental sofra de DRGE.
A DRGE envolve disfunção na barreira da junção esofagogástrica, incluindo perda da função efetiva do esfíncter esofágico inferior, permitindo maior regurgitação do conteúdo gástrico ácido para o esôfago. O relaxamento transitório do esfíncter esofágico inferior é uma resposta fisiológica normal à distensão gástrica que facilita o arroto, mas pode contribuir para a DRGE, se os relaxamentos forem frequentes e prolongados.
A hérnia hiatal deslizante (ou seja, na qual uma parte do estômago proximal herniou através do diafragma está localizada na cavidade torácica), é uma configuração anatômica comum que facilita o refluxo, aumentando a angulação entre a junção gastroesofágica e o fundo gástrico, reduzindo a função da válvula.
Etiologia
O aumento do índice de massa corporal (IMC) de normal para obeso, está associado ao aumento do risco de desenvolver DRGE, com uma prevalência de DRGE de 22,1% entre indivíduos obesos em comparação com 14,2% dos não obesos. O aumento da pressão intra-abdominal, uma maior prevalência de hérnia hiatal, maior gradiente de pressão abdominal para torácica, aumento dos níveis de estrogênio e aumento da produção de bile e enzimas pancreáticas, podem contribuir para a associação entre obesidade e DRGE.
Uma associação entre tabagismo e DRGE também está bem documentada, com uma prevalência combinada de 19,6% entre fumantes e 15,9% em não fumantes. O tabaco pode prolongar o tempo de eliminação do ácido do esôfago e reduzir a pressão no esfíncter esofágico inferior.
O terceiro fator de risco bem estabelecido é a predisposição genética. Dois grandes estudos de gêmeos estimaram que a herdabilidade é responsável por 31% a 43% da predisposição para desenvolver DRGE, e alguns estudos indicaram fatores de risco genéticos para o desenvolvimento de DRGE, embora nenhum locus de risco específico tenha sido identificado ainda.
A infecção por H. pylori, ao contrário, pode prevenir a DRGE, causando atrofia da mucosa gástrica, o que pode diminuir a produção de ácido das células parietais. A erradicação do H. pylori aumenta o risco de desenvolver esofagite de refluxo. O consumo de álcool e fatores dietéticos podem precipitar episódios de sintomas semelhantes em indivíduos com DRGE conhecida, mas essas exposições não foram associadas ao desenvolvimento de DRGE.

Causas de DRGE
Pacientes com DRGE têm um mecanismo de válvula ineficaz entre o esôfago e o estômago (esfíncter esofágico inferior), o que impede que o conteúdo do estômago volte para o esôfago. A DRGE ocorre com mais frequência se uma parte do estômago for empurrada para a cavidade torácica, uma condição chamada hérnia de hiato. Os fatores de risco para o desenvolvimento de DRGE são obesidade, tabagismo e hereditariedade.
Diagnósticos diferenciais na avaliação de um paciente com suspeita de DRGE
Diagnóstico diferencial Sintomas Exame diagnóstico principal
Doença coronariana Dor no peito, ECG, Troponina e CK-MB Malignidade gastrointestinal Dificuldade alimentar Endoscopia
perda de peso, vômitos
Úlcera péptica Dor epigástrica, náusea Endoscopia
vômito
Doença do trato biliar Dor abdominal, icterícia US abdome, exames sangue Esofagite eosinofílica Dificuldades de engolir Endoscopia
sintomas de refluxo
Acalasia Dificuldades para engolir Manometria esofágica ou distúrbios da motilidade GI vômito de comida não digerida
Apresentação clínica
Os sintomas mais comuns da DRGE são sensações de queimação atrás do esterno (azia) ou a sensação de regurgitação do conteúdo do estômago na parte superior da garganta (regurgitação ácida). Em indivíduos com sintomas típicos, o tratamento geralmente é prescrito sem exames adicionais. A DRGE de longa data pode levar à inflamação do esôfago e também a alterações celulares no esôfago, que aumentam ligeiramente o risco de desenvolver câncer de esôfago.
Os principais sintomas da DRGE são azia e regurgitação ácida, mas a dor no peito também é comum. Os sintomas menos comuns, frequentemente denotados como atípicos, incluem disfagia, sangramento, tosse crônica, asma, laringite crônica, rouquidão, erosões dos dentes, arrotos e distensão abdominal.
Além disso, os pacientes podem apresentar sintomas extraesofágicos como tosse, rouquidão, pigarro, dor ou queimação na garganta, sibilos e distúrbios do sono. Uma associação entre DRGE sintomas na garganta e na voz é amplamente citado e sintomas relacionados foram descritos usando uma variedade de termos, incluindo refluxo extraesofágico, refluxo laringofaríngeo e laringite de refluxo.
Pacientes com sintomas de DRGE combinados com sintomas de alerta de malignidade, como disfagia progressiva, perda involuntária de peso ou sangramento, devem ser submetidos à endoscopia gastrointestinal alta. Pacientes que não respondem a um estudo empírico de tratamento médico com um inibidor da bomba de prótons (IBP) de dose padrão uma vez ao dia também devem ser considerados para endoscopia. A endoscopia pode revelar malignidade, complicações da DRGE (por exemplo, esofagite erosiva, estenoses esofágicas, esôfago de Barrett) e outras explicações para os sintomas. Pacientes com DRGE geralmente apresentam redução da qualidade de vida relacionada à saúde, mas isso pode ser melhorado com um tratamento eficaz.
Diagnóstico
O uso de outros testes de diagnóstico, como PHmetria, Endoscopia com cápsula sem fio, PHmetria por impedância e outros, são reservados para cenários clínicos específicos, quando é necessário um gerenciamento adicional em pacientes que apresentaram parcial ou completa falta de resposta ao tratamento com inibidores da bomba de prótons (IBPs).
Laringoscopia direta > mostra sinais diretos ou indiretos de DRGE, e é importante para excluir doenças das cordas vocais como pólipos ou tumores
Endoscopia digestiva alta > é indicada na presença de sintomas de alarme ou que sugiram doença complicada (sintomas atípicos, persistentes ou recidivantes). Endoscopia de rotina para avaliar a progressão da doença em indivíduos com DRGE erosiva ou não erosiva não é recomendada. A vigilância endoscópica é recomendada pela maioria das diretrizes para pacientes com esôfago de Barrett. Após, pelo menos, dois exames endoscópicos com 1 ano de intervalo, sem evidência de progressão da doença, os intervalos de vigilância para pacientes com esôfago de >arrett sem displasia provavelmente podem ser estendidos para 3 anos.
Phmetria ambulatorial de 24 horas > pode demonstrar exposição anormal ao ácido esofágico na ausência de esofagite
Phmetria por cápsula de radiotelemetria sem fio por 24 a 48 horas > utiliza para o registro do pH intra-esofágico uma cápsula que é fixada à mucosa do esôfago através da endoscopia. Resulta em menos desconforto e menos interrupções das atividades diárias.
PHmetria de impedância > pode detectar refluxo ácido e não ácido, para avaliar a correlação com os sintomas.
Manometria esofágica > avalia as contrações esofágicas e a função do esfíncter esofágico inferior. Ela pode detectar manifestações sutis de distúrbios de motilidade esofágicos, como acalasia ou espasmo esofágico difuso.
Endoscopia por cápsula esofágica > envolve a ingestão de uma cápsula endoscópica para visualizar o esôfago. A endoscopia por cápsula não requer sedação. É uma alternativa menos invasiva que a endoscopia digestiva alta e como uma possível ferramenta de rastreamento e diagnóstico para avaliar a patologia esofágica.
Endoscopia digestiva com sonda de imagem do lúmen funcional endoluminal > avaliação baseada em cateter que mede simultaneamente a área transversal, a distensibilidade e a pressão intraluminal do esôfago. Realizada durante a endoscopia digestiva alta.
Endoscopia com deglutição orofaríngea > demonstrou ser um instrumento eficaz no diagnóstico das disfagias orofaríngeas. O exame consiste em uma tradicional nasofibrolaringoscopia com o oferecimento de alimentos tingidos com corantes, possibilitando uma visualização da dinâmica da deglutição, especialmente em sua fase faríngea, cuja grande importância está na presença do caminho concomitante entre as vias respiratória e digestiva.
Tratamento
Os médicos podem aconselhar os pacientes com sintomas de DRGE a fazer mudanças no estilo de vida, como perder peso e parar de fumar. O tratamento médico de primeira linha para a DRGE é um inibidor da bomba de prótons (IBP), como omeprazol ou esomeprazol. Os inibidores da bomba de prótons inibem a produção de ácido nas células da parede do estômago, reduzindo assim o conteúdo ácido e os sintomas da DRGE. A maioria dos pacientes com sintomas de DRGE é prescrita a um ensaio com IBP, no qual tomam um IBP diariamente por algumas semanas e, se os sintomas diminuem claramente, ele fornece evidências para o diagnóstico de DRGE.
As modificações no estilo de vida continuam sendo a pedra angular de qualquer intervenção terapêutica para a DRGE, que geralmente é ignorada pelos médicos, e não seguida pelos pacientes. Embora os pacientes relatem que tabaco, chocolate, bebidas carbonatadas, cebola, molho de tomate, hortelã, álcool, sucos cítricos, refeições apimentadas e gordurosas, exacerbam seus sintomas relacionados à sintomas de DRGE, ainda não temos ensaios de alta qualidade, que fornecem evidências claras do valor de evitar esses produtos ou hábitos alimentares.
Uma revisão sistemática de ensaios clínicos que examinaram o impacto das modificações no estilo de vida na DRGE por alterações nos sintomas, variáveis de pH esofágico ou pressão basal do esfíncter esofágico inferior, mostrou que há falta ou evidência fraca de que, após a interrupção do tabaco, álcool, chocolate, cafeína ou café, alimentos cítricos, menta ou condimentados, haja melhora nos parâmetros clínicos ou fisiológicos da DRGE.
A obesidade demonstrou ser um importante fator de risco para o desenvolvimento ou agravamento da DRGE. Assim, a perda de peso parece ser uma modificação eficaz no estilo de vida para melhorar a DRGE. É importante ressaltar que foi demonstrado que as modificações no estilo de vida associadas ao sono, melhoram os sintomas relacionados à DRGE e até curam EE leve.
Além de elevar a cabeceira da cama, os pacientes devem evitar comer pelo menos 3 horas antes da hora de dormir, e evitar a posição de decúbito direito durante o sono. Além disso, os pacientes devem melhorar sua higiene do sono, porque o sono reduz o refluxo gastroesofágico, suprimindo os relaxamentos transitórios do esôfago inferior.
Posologia dos Inibidores das Bombas de Prótons
Iniciar o tratamento com a menor dose eficaz do inibidor da bomba de prótons (IBPs) por 8 a 12 semanas.
Omeprazol: (Losec - Astrazeneca) 40-80 mg por via oral uma vez ao dia
Esomeprazol: (Nexium - Astrazeneca) 20-40 mg por via oral uma vez ao dia
Rabeprazol: (Pariet - Janssen) 20 mg por via oral uma vez ao dia
Pantoprazol: (PantoCal - EMS e Divena - Aché) 40 mg por via oral uma vez ao dia
Lansoprazol: (Legrand e Lanz - EMS) 15-30 mg por via oral uma vez ao dia
Dexlansoprazol: ( Dexilant - Takeda) 30-60 mg por via oral uma vez ao dia
Equivalência entre inibidores da bomba de prótons com o Omeprazol em mg Omeprazol 20 20 Esomeprazol 20 32 Rabeprazol 20 36 Pantoprazol 20 4,5 Lansoprazol 15 13,5 Dexlansoprazol 30 13,5
Recomendações
As medidas incluem: perda de peso para pessoas com sobrepeso; abandono do hábito de fumar para fumantes de tabaco; elevação da cabeceira do leito; e evitar comer muito tarde se houver sintomas noturnos, mínimo de 2 horas antes de deitar-se.
A eliminação de alimentos de rotina (por exemplo, chocolate, cafeína, álcool, alimentos
ácidos e/ou condimentados) não é necessária, a não ser que as mudanças seletivas forneçam
benefício individual.
Cirurgia
Em alguns pacientes, especialmente pessoas jovens e saudáveis, um procedimento cirúrgico conhecido como fundoplicatura pode ser considerado. Durante uma fundoplicatura, a parte superior do estômago é envolvida ao redor do esôfago inferior, evitando, assim, mecânica e fisiologicamente a DRGE.
A terapia endoscópica antirrefluxo pode ser considerada em pacientes selecionados com doença do refluxo gastroesofágico (DRGE) não complicada, após discussão cuidadosa com o paciente quanto a possíveis efeitos adversos, benefícios e outras opções terapêuticas disponíveis.
A cirurgia (por exemplo, fundoplicatura aberta, fundoplicatura laparoscópica, aumento do esfíncter magnético) é reservada principalmente para pessoas que tem hérnia de hiato ou tiveram uma boa resposta aos IBPs, mas que não aderiram à terapia ou não desejam fazer tratamento médico de longo prazo (por exemplo, devido a efeitos adversos). As pessoas que não respondem aos IBPs provavelmente não responderão à cirurgia.
Apenas uma pequena porcentagem da população de pacientes com DRGE é submetida a cirurgia antirrefluxo a cada ano. Todos os pacientes devem ser envolvidos na decisão de iniciar a cirurgia antirrefluxo. As complicações pós-cirúrgicas ocorrem em até 20% dos pacientes.
Metanálises de ensaios clínicos randomizados e controlados indicam que, em curto prazo, os desfechos de qualidade de vida relacionados à DRGE podem ser superiores após a cirurgia do que o tratamento médico. A eficácia da cirurgia a longo prazo não é clara; os benefícios devem ser ponderados em relação ao risco de mortalidade e outros efeitos adversos.
Doença do Refluxo Laringofaríngeo: sintomas persistentes na garganta
Os sintomas persistentes de garganta são uma apresentação comum na atenção primária e secundária e principalmente compreendem rouquidão; a sensação de um caroço na garganta (globus); pigarro repetido; muco na garganta ou “catarro”; tosse; e desconforto na garganta. A prevalência de globus sozinho em mulheres de meia-idade é cerca de 6%, com uma incidência populacional vitalícia de mais de 40%.
A doença do refluxo gastroesofágico (DRGE) afeta a 20% da população ocidental. Uma associação entre DRGE sintomas na garganta e na voz é amplamente citado e sintomas relacionados foram descritos usando uma variedade de termos, incluindo refluxo extraesofágico, refluxo laringofaríngeo e laringite de refluxo.
Avalia-se a gravidade por meio do índice de sintomas de refluxo (RSI), um questionário de autorrelato do paciente bem estabelecido, amplamente utilizado em clínicas otorrinolaringologia geral. É também uma das poucas ferramentas com dados publicados sobre sensibilidade à mudança e com faixas normativas para a população em geral. O último dos nove itens do RSI é uma questão DRGE composta que cobre azia, dor no peito, indigestão ou ácido estomacal pelo refluxo. Embora o limite superior da norma populacional de RSI seja geralmente considerado como 12 pontos, pelo menos 5 dos 12 pontos podem ser alcançados por endosso máximo de dispepsia. Para garantir que os pacientes tivessem um nível de gravidade qualificado para os itens não dispepsia (ou seja, os sintomas de garganta em questão), todos os participantes deveriam marcar pelo menos 10 pontos nos itens 1 a 8 do RSI.
Este estudo descobriu que o lansoprazol não oferece nenhum benefício em relação ao placebo para pacientes com sintomas persistentes de garganta. Nenhuma tendência foi a favor do lansoprazol. Os pacientes que receberam lansoprazol em média relataram piora nos sintomas do que aqueles que receberam placebo. O tratamento de pacientes com sintomas persistentes de garganta relatados “empiricamente” com IBP, na ausência de investigações especializadas, é uma prática comum por profissionais de saúde em todo o mundo. Isso agora deve ser desencorajado por meio de diretrizes de tratamento baseadas em evidências.
Diretrizes recentes sobre tosse crônica, que anteriormente defendiam ensaios de IBP para sintomas presumidos de refluxo, incorporaram evidências de alto nível e estudos controlados com placebo de IBPs e agora afirmam que os tratamentos de redução de ácido não devem ser prescritos rotineiramente para essa condição.
No entanto, os resultados parecem essencialmente aplicáveis a qualquer inibidor da bomba de prótons, quando usado para o tratamento de pacientes com sintomas persistentes de garganta, em cuidados primários e secundários. Nenhuma evidência foi encontrada para mostrar superioridade de um IBP sobre outro para DRGE, para o qual os IBPs estão bem estabelecidos como tratamento eficaz. Além disso, o regime de IBP para sintomas laringofaríngeos na atenção secundária, geralmente é de duas vezes ao dia por dois a seis meses.
Os sintomas melhoraram igualmente ao longo do tempo entre os IBPs e o placebo, mas os sintomas dos pacientes não se reduziu aos da população em geral. Portanto, existe uma necessidade clara de investigar mais eficazmente estratégias de tratamento. Nossos resultados podem apoiar o foco renovado de pesquisa no bem estabelecido sintomas psicológicos concomitantes da garganta em alguns pacientes, ou seja, ansiedade, angústia, depressão e sintomas físicos persistentes coexistentes. Estratégias que empregam as técnicas de reatribuição (oferecendo explicações alternativas para as causas dos sintomas), ajustes no estilo de vida e modificação do comportamento da fala (fonoterapia) ou terapia cognitivo-comportamental parecem ser relevante e um foco razoável de pesquisas futuras.
Grande interesse clínico foi demonstrado em atribuir sintomas da garganta e das vias aéreas superiores às manifestações de DRGE. O interesse está crescendo no refluxo fracamente ácido, ou no não ácido, que intuitivamente parece menos provável de responder aos IBPs, embora contenha os outros elementos importantes do conteúdo gástrico. Existem poucas evidências sobre o papel de outros fatores que podem reduzir os sintomas persistentes de garganta relacionados ao refluxo, como dieta e estilo de vida.
Não se deve descartar o refluxo como causa ou fator contribuinte para os sintomas de alguns pacientes e, embora o refluxo do conteúdo gástrico contendo pepsina possa estar implicado em alguns pacientes, a definição de tais indivíduos, e o manejo adequado precisam de mais pesquisas. Isso requer esclarecimento sobre o uso e interpretação de investigações especializadas para identificar episódios de refluxo e resposta aos tratamentos.
Não se pode negar a existência de uma conexão entre RGE e pneumopatias. Algumas doenças respiratórias, como asma, pneumonia aspirativa e mesmo fibrose pulmonar idiopática, são reconhecidamente condições associadas ao refluxo. Outras doenças, como DPOC, fibrose cística, bronquiectasias, entre outras, são menos comummente citadas.
Esta relação entre DRGE e doenças pulmonares deve ser sempre cogitada, diante de um quadro respiratório crônico persistente, recidivante e resistente ao tratamento, no qual a história sugira, fortemente, essa ligação e exista alguma confirmação através dos resultados dos exames complementares.
Uma observação importante é que nem sempre o refluxo é sintomático, e o seu reconhecimento precoce e tratamento podem melhorar, na maioria dessas doenças, os sintomas pulmonares e a consequente qualidade de vida
dos doentes. Uma investigação mais aprofundada e desejável é necessária, para corroborar os mecanismos e o efeito do tratamento antirefluxo sobre as doenças pulmonares.

Vacina conjugada pneumocócica 15-valente imunogênica, segura em bebês saudáveis
Comentário publicado no Medscape Pulmonary Medicine em 24/08/2021, onde um pesquisador americano comenta que a Vaxneuvance, já liberadas para adultos, tem o potencial de desempenhar um papel importante na prevenção da doença pneumocócica invasiva também em crianças.
Os resultados da Topline foram anunciados a partir de um estudo de fase 3 que avaliou a segurança, tolerabilidade e imunogenicidade da vacina pneumocócica conjugada 15-valente (Vaxneuvance ™) em bebês saudáveis.
A Vaxneuvance consiste em polissacarídeos pneumocócicos de 15 sorotipos, incluindo os serotipos 22F e 33F, que estão associados à doença pneumocócica invasiva. O estudo PNEU-PED multicêntrico, randomizado, duplo-cego e controlado por comparador ativo, incluiu 1.720 bebês saudáveis inscritos com 42 a 90 dias de idade. Os pacientes foram aleatoriamente designados para receber um total de 4 doses de 0,5mL de injeções intramusculares de Vaxneuvance ou PCV13 (Prevnar 13), aos 2, 4, 6 e 12 a 15 meses de idade.
Os resultados mostraram que o ensaio atingiu seus objetivos primários e secundários principais. Verificou-se que a Vaxneuvance não é inferior ao PCV13 para todos os 13 sorotipos compartilhados, 30 dias após a terceira dose (com base nas taxas de resposta específicas do sorotipo), e para 12 dos 13 sorotipos compartilhados (com base nas concentrações médias geométricas de imunoglobulina G específicas do sorotipo). 30 dias após a quarta dose, o Vaxneuvance foi considerado não inferior ao PCV13 para todos os 13 serotipos compartilhados (com base nas concentrações médias geométricas de imunoglobulina G específicas do serotipo).
Em comparação com a PCV13, respostas imunes estatisticamente superiores foram observadas com Vaxneuvance para sorotipo 3 compartilhado, e serotipos 22F e 33F. Os pacientes administrados com Vaxneuvance ou PCV13, também demonstraram respostas imunes não inferiores aos antígenos contidos em várias vacinas pediátricas, usadas rotineiramente quando administradas concomitantemente.
O perfil de segurança de Vaxneuvance foi geralmente comparável ao de PCV13, após qualquer dose. Os resultados completos do estudo PNEU-PED, juntamente com o estudo de fase 3 PNEU-LINK em bebês saudáveis, serão apresentados em um próximo congresso científico.
O Dr. Roy Baynes, diretor médico da Merck Research Laboratories, disse: “Com a inclusão dos serotipos 22F e 33F, Vaxneuvance tem o potencial de desempenhar um papel importante na prevenção da doença pneumocócica invasiva em crianças.”
Em julho de 2021, a Food and Drug Administration (FDA) aprovou a Vaxneuvance para a prevenção da doença pneumocócica invasiva causada por Streptococcus pneumoniae serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F e 33F em adultos com 18 anos de idade e mais velhos.
A empresa espera apresentar um pedido de licença regulamentar suplementar ao FDA para o uso de Vaxneuvance em crianças antes do final do ano.

Transmissão aérea de vírus respiratórios
Artigo de revisão publicado no Science em 27/08/2021, em que pesquisadores de diversos países comentam sobre a transmissão aérea de diversos vírus respiratórios, aqui incluído o SARS -CoV-2.
Ao longo do século passado, pensava-se que os vírus respiratórios se espalhavam principalmente por meio de grandes gotículas respiratórias, produzidas na tosse e espirros de indivíduos infectados, que se depositam nas membranas mucosas dos olhos, nariz ou boca de potenciais hospedeiros, a chamada transmissão por gotículas; ou que se depositaram em superfícies que são tocadas por potenciais hospedeiros, e transferidas para as membranas mucosas, as chamadas transmissão de fômites.
Acredita-se que essas gotículas caiam no solo, a uma distância de 1 a 2 m da pessoa infectada, uma suposição-chave usada pela maioria das agências de saúde pública, ao recomendar uma distância segura de pessoas infectadas com vírus respiratórios. Considerada menos comum, a transmissão aérea refere-se à inalação de aerossóis infecciosos ou "núcleos de gotículas", as gotículas que evaporam no ar, muitas vezes definidas como menores que 5 μm, e que percorrem distâncias maior que 1 a 2 m de distância do infectado Individual. Aerossóis são partículas microscópicas líquidas, sólidas ou semissólidas que são tão pequenas, que permanecem suspensas no ar. Os aerossóis respiratórios são produzidos durante todas as atividades expiratórias, incluindo respirar, falar, cantar, gritar, tossir e espirrar, tanto em indivíduos saudáveis, quanto naqueles com infecções respiratórias.
A definição histórica de transmissão aérea, ignora a possibilidade de que os aerossóis também possam ser inalados próximos a uma pessoa infectada, onde a exposição é mais provável, porque os aerossóis exalados estão mais concentrados perto da pessoa que os está emitindo. Além disso, ao invés da definição convencional de 5 μm, recentemente foi sugerido que a distinção de tamanho entre aerossóis e gotas deveria ser atualizada para 100 μm, já que isso distingue entre os dois, com base em seu comportamento aerodinâmico.
=> Especificamente, as gotículas de 100 μm representam as maiores partículas, que permanecem suspensas no ar parado por > 5 s (de uma altura de 1,5 m), viajam além de 1 m da pessoa infecciosa, e podem ser inaladas. Embora gotículas produzidas por um indivíduo infeccioso por meio de tosse ou espirro, possam transmitir infecção em distâncias curtas (< 0,5 m), o número e a carga viral de aerossóis produzidos por meio da fala e outras atividades expiratórias, são muito maiores do que as de gotículas.
=> Os aerossóis são pequenos o suficiente para permanecerem no ar, se acumularem em espaços mal ventilados, e serem inalados em intervalos curtos e longos, exigindo uma necessidade urgente de incluir precauções de aerossol nos protocolos atuais de controle de doenças respiratórias. Durante a pandemia COVID-19, os controles se concentraram principalmente na proteção contra a transmissão de gotículas e fômites, enquanto a rota aérea exigiu muito mais evidências, antes que os controles pudessem ser adicionados para proteção contra ela.
Os debates em torno da importância relativa dos diferentes modos de transmissão, na propagação de doenças respiratórias, duraram séculos. Antes do século 20, acreditava-se que as doenças respiratórias infecciosas se propagavam por meio de “partículas pestilentas” liberadas por indivíduos infectados. Esta visão da transmissão aérea foi rejeitada no início de 1900 por Charles Chapin, que alegou que o contato era a principal via de transmissão de doenças respiratórias, sendo a transmissão por spray (gota) uma extensão da transmissão por contato. Chapin estava preocupado com o fato de que a menção à transmissão por via aérea assustaria as pessoas, e deixaria as pessoas inativas, e deslocaria as práticas de higiene. Chapin equivocou erroneamente as infecções em curta distância com a transmissão por gotículas, negligenciando o fato de que a transmissão por aerossol também ocorre em curtas distâncias. Esta suposição sem suporte, tornou-se generalizada em estudos epidemiológicos, e as estratégias de mitigação para controlar a transmissão do vírus respiratório, têm se concentrado em limitar a transmissão por gotículas e fômites. Algumas dessas estratégias também são parcialmente eficazes para limitar a transmissão do aerossol, levando à conclusão errônea, de que sua eficácia comprovou a transmissão por gotículas.
Apesar da suposta predominância da transmissão por gotículas, há evidências robustas que apoiam a transmissão aérea de muitos vírus respiratórios, incluindo o vírus do sarampo, vírus influenza, vírus sincicial respiratório (RSV), rinovírus humano (hRV), adenovírus, enterovírus, síndrome respiratória aguda grave coronavírus (SARS-CoV), síndrome respiratória do Oriente Médio coronavírus (MERS-CoV) e SARS -CoV-2.
Estima-se que a transmissão aérea, seja responsável por aproximadamente metade da transmissão do vírus influenza A, em um estudo em ambiente doméstico. Um estudo de desafio humano sobre a transmissão do rinovírus concluiu, que os aerossóis eram provavelmente o modo de transmissão dominante. A infecção por SARS-CoV-2 de hamsters e furões, demonstrou transmitir através do ar em configurações experimentais projetadas para excluir contribuições de contato direto e transmissão de gotículas. A análise das emissões respiratórias durante a infecção com vírus influenza, vírus parainfluenza, RSV, metapneumovírus humano e hRV, revelou a presença de genomas virais em uma variedade de tamanhos de aerossol, com a maior quantidade detectada em aerossóis < 5 μm, em vez de aerossóis maiores.
O RNA do SARS-CoV-2 foi detectado, e o vírus infeccioso foi recuperado, em aerossóis variando de 0,25 a > 4 μm. O RNA do vírus da gripe também foi detectado em aerossóis finos (≤ 5 μm) e grossos (> 5 μm), exalados de indivíduos infectados, com mais RNA viral contido nas partículas finas de aerossol. Estudos de laboratório descobriram que o SARS-CoV-2 aerossolizado, tem meia-vida de aproximadamente 1 a 3 horas. A Organização Mundial da Saúde (OMS) e os Centros de Controle e Prevenção de Doenças (CDC) dos EUA, reconheceram oficialmente a inalação de aerossóis carregados de vírus, como o principal modo de espalhar o SARS-CoV-2 em intervalos curtos e longos, em abril e maio de 2021, respectivamente.

Aerossóis carregados de vírus (< 100 μm - 1/4m) são gerados primeiro por um indivíduo infectado por meio de atividades expiratórias, por meio das quais são exalados e transportados para o ambiente. Eles podem ser inalados por um hospedeiro potencial para iniciar uma nova infecção, desde que permaneçam infecciosos. Em contraste com as gotículas (> 100 μm - 1/4m), os aerossóis podem permanecer no ar por horas e viajar além de 1 a 2 m do indivíduo infectado que os exala, causando novas infecções em curto e longo alcance.
=> A modelagem matemática, da exposição a patógenos respiratórios, apoia que a transmissão é dominada pela inalação de aerossol de curto alcance, na maioria das distâncias dentro de 2 m da pessoa infecciosa, e as gotas só são dominantes quando os indivíduos estão a 0,2 m ao falar ou 0,5 m ao tossir.
As observações anedóticas do vírus do sarampo e da infecção por Mycobacterium tuberculosis nas proximidades, anteriormente atribuídas apenas a gotículas, incluem a transmissão por aerossóis a curta distância. Mais estudos são necessários para doenças respiratórias, cuja transmissão foi previamente caracterizada como impulsionada por gotículas, porque é plausível que a transmissão aérea seja importante ou mesmo dominante, para a maioria delas.
No início da pandemia de COVID-19, presumia-se que gotículas e fômites eram as principais rotas de transmissão, com base no número de reprodução básico relativamente baixo (R0), em comparação com o do sarampo. R0 é o número médio de infecções secundárias causadas por um indivíduo infectado primário em uma população homogeneamente suscetível. Esse argumento foi construído com base em uma crença de longa data, de que todas as doenças transmitidas pelo ar devem ser altamente contagiosas. No entanto, não há base científica para tal suposição, porque as doenças transmitidas pelo ar, exibem uma faixa de valores de R0 que não podem ser bem representados por um único valor médio, que depende de vários fatores.
Por exemplo, a tuberculose (R0, 0,26 a 4,3) é uma infecção bacteriana transmitida pelo ar obrigatória, mas é menos transmissível do que a COVID-19 (R0, 1,4 a 8,9). Os fatores que afetam a transmissão aérea, incluem carga viral em partículas respiratórias de tamanhos diferentes, a estabilidade do vírus em aerossóis, e a relação dose-resposta para cada vírus, ou seja, a probabilidade de infecção dada a exposição a um certo número de vírions por meio de uma rota de exposição específica.
=> Além disso, a R0 é uma média e a COVID-19 é super dispersa, o que significa que, sob certas condições, pode ser altamente contagiosa. Estudos epidemiológicos descobriram que 10 a 20% dos indivíduos infectados, respondem por 80 a 90% das infecções subsequentes por SARS-CoV-2, destacando a heterogeneidade nas taxas de ataque secundário, que é a proporção de indivíduos expostos que são infectados.
=> Um crescente corpo de pesquisa sobre COVID-19, fornece evidências abundantes para a predominância da transmissão aérea do SARS-CoV-2. Esta rota domina sob certas condições ambientais, particularmente ambientes internos que são mal ventilados, uma observação que implica apenas os aerossóis, porque apenas os aerossóis, e não gotas grandes ou superfícies, são afetadas pela ventilação.
Além disso, a diferença marcante entre as taxas de transmissão interna e externa só pode ser explicada, pela transmissão aerotransportada, porque grandes gotas, cujas trajetórias são afetadas pela sedimentação gravitacional, mas não pela ventilação, se comportam de forma idêntica em ambos os ambientes. Várias combinações de análises epidemiológicas; simulações de modelo de fluxo de ar; experimentos com traçadores; e análise e modelagem de eventos de superespalhamento em restaurantes, em frigoríficos, em um navio de cruzeiro, durante o canto em um ensaio de coral e a transmissão de longa distância em uma igreja, todos implicam aerossóis como o modo mais provável de transmissão, do que em fômites ou gotículas.
É altamente improvável, que a maioria das pessoas em qualquer um desses eventos, toquem a mesma superfície contaminada, ou sejam expostas a gotículas produzidas pela tosse ou espirro de uma pessoa infecciosa de perto, e encontrem carga de vírus suficiente para causar infecção. No entanto, o único fator comum para todas as pessoas nesses eventos internos, é o ar compartilhado que elas inalam na mesma sala.
=> As semelhanças entre os eventos de superespalhamento incluem ambientes internos, multidões, durações de exposição de 1 hora ou mais, ventilação deficiente, vocalização e falta de máscaras adequadamente usadas. Dado que a transmissão de gotículas domina apenas quando os indivíduos estão dentro de 0,2 m ao falar, e que a transmissão de SARS-CoV-2 através de superfícies contaminadas é menos provável, os eventos de superespalhamento só podem ser explicados incluindo aerossóis, como um modo de transmissão.
Para estabelecer diretrizes e políticas eficazes de proteção, contra a transmissão aérea de vírus respiratórios, é importante compreender melhor os mecanismos envolvidos. Para que a transmissão aérea ocorra, os aerossóis devem ser gerados, transportados pelo ar, inalados por um hospedeiro suscetível e depositados no trato respiratório para iniciar a infecção. O vírus deve reter sua infectividade ao longo desses processos.
Nesta revisão, discutimos os processos envolvidos na geração, transporte e deposição de aerossóis carregados de vírus, bem como os parâmetros importantes que influenciam esses processos, que são críticos, para informar medidas eficazes de controle de infecção.
Geração de aerossóis carregados de vírus
As atividades expiratórias produzem aerossóis de diferentes locais do trato respiratório, por meio de mecanismos distintos. Aerossóis produzidos por atividades como respirar, falar e tossir, exibem diferentes distribuições de tamanho de aerossol e velocidades de fluxo de ar, que por sua vez, governam os tipos e cargas de vírus que cada partícula de aerossol pode transportar, o tempo de residência no ar, a distância percorrida e, finalmente, os locais de deposição no trato respiratório de uma pessoa que os inala. Aerossóis liberados por um indivíduo infectado podem conter vírus, bem como eletrólitos, proteínas, surfactantes e outros componentes no fluido que reveste as superfícies respiratórias.

Propriedades físico-químicas de aerossóis carregados de vírus. O comportamento e o destino dos aerossóis carregados de vírus são inerentemente governados por suas propriedades características, incluindo tamanho físico, carga viral, infecciosidade, outros componentes químicos no aerossol, carga eletrostática, pH e propriedades interfaciais ar-líquido.
Locais de formação de aerossol
Os aerossóis respiratórios podem ser classificados em aerossóis alveolares, bronquiolares, brônquicos, laríngeos e orais, de acordo com os locais onde são produzidos. Aerossóis bronquiolares são formados durante a respiração normal. Durante a expiração, o filme líquido que reveste as superfícies luminais dos bronquíolos se rompe, para produzir pequenos aerossóis. Esses aerossóis são gerados por forças de cisalhamento que desestabilizam a interface ar-líquido ou ar-muco. Os fluxos de ar respiratório são frequentemente turbulentos sob altas velocidades de fluxo de ar, particularmente nos grandes lúmens das vias aéreas superiores, que fazem a transição para o fluxo laminar nos brônquios e bronquíolos.
Os aerossóis laríngeos são gerados pelas vibrações das pregas vocais durante a vocalização. A aposição das pregas vocais forma pontes líquidas, que explodem em aerossóis durante a expiração. Em contraste, as gotículas (> 100 µm) são produzidas principalmente a partir da saliva na cavidade oral. As taxas de emissão de aerossóis aumentam com a velocidade do fluxo de ar e o volume da fala, durante atividades como cantar e gritar.
Distribuições de número e tamanho
O tamanho dos aerossóis exalados é uma das propriedades mais influentes que governam seu destino, porque o tamanho não apenas determina suas características aerodinâmicas, mas também sua dinâmica de deposição e o local da infecção.
Distribuições de tamanho de aerossóis respiratórios têm sido investigadas desde a década de 1890 usando várias abordagens, incluindo microscopia óptica, fotografia de alta velocidade e, mais recentemente, técnicas de detecção baseadas em laser. Os primeiros estudos usaram técnicas de medição e métodos analíticos que eram incapazes de detectar aerossóis < 5 μm, mas os instrumentos atuais, como os sistemas aerodinâmicos e de mobilidade de varredura de dimensionamento de partículas, permitiram a detecção de aerossóis menores. Aerossóis respiratórios produzem uma distribuição de tamanho multimodal, com picos em torno de 0,1 μm, 0,2 a 0,8 μm, 1,5 a 1,8 μm e 3,5 a 5,0 μm, cada um representando um local de geração diferente, processo de produção e atividade expiratória. Quanto menor o tamanho modal, mais profundos os aerossóis se originam no trato respiratório. Um modo maior centrado em 145 μm para falar e 123 μm para tosse origina-se principalmente da cavidade oral e lábios.
Em termos de número, a maioria dos aerossóis exalados são < 5 μm, e uma grande fração é < 1 μm para a maioria das atividades respiratórias, incluindo aquelas produzidas durante a respiração, fala e tosse. No geral, a fala produz de 100 a 1000 vezes o número de aerossóis < 100 μm de tamanho para cada gota > 100 μm.
=> Foi demonstrado que a respiração normal libera até 7200 partículas de aerossol por litro de ar exalado. O número de aerossóis carregados de vírus expelidos por indivíduos durante a respiração, varia amplamente entre os indivíduos e depende do estágio da doença, idade, índice de massa corporal e condições de saúde preexistentes. As crianças geralmente produzem menos aerossóis carregados de vírus do que os adultos, porque seus pulmões ainda estão em desenvolvimento, e têm menos bronquíolos e alvéolos nos quais os aerossóis podem se formar.
=> Os processos envolvidos na formação de aerossol, particularmente as propriedades do fluido que reveste as vias aéreas que afetam sua propensão a se fragmentar para formar aerossóis, desempenha um papel crucial no número de aerossóis exalados. Um estudo mostrou que 1 minuto de fala pode produzir pelo menos 1000 aerossóis.
=> Embora a tosse possa produzir mais aerossóis em um curto período de tempo, é muito mais esporádica do que a respiração e a fala contínuas, especialmente para indivíduos infectados que não apresentam sintomas clínicos. Portanto, a respiração, a fala e outras vocalizações contínuas de indivíduos infectados, provavelmente liberarão mais aerossóis carregados de vírus em geral do que uma tosse menos frequente.
Conteúdo viral de aerossóis
A carga viral dos aerossóis é um fator chave na determinação da contribuição relativa da transmissão aérea. No entanto, a amostragem e detecção de vírus transportados pelo ar é um desafio, devido às suas baixas concentrações no ar, e suscetibilidade à destruição e inativação, durante a amostragem. As amostras de ar são frequentemente analisadas quanto à presença de genomas virais por métodos quantitativos de reação em cadeia da polimerase (qPCR) ou PCR de transcrição reversa quantitativa (qRT-PCR), que são altamente sensíveis. No entanto, a presença de material genético, por si só, não indica se o vírus é infeccioso.
A viabilidade dos vírus depende da integridade e função de seu material genômico, nucleoproteína, capsídeo e/ou envelope. Embora alguns estudos tenham tentado e falhado a cultura de vírus do ar, o uso de métodos mais sensíveis, como um dispositivo de coleta de condensação de líquido, permitiu a detecção de vários vírus respiratórios viáveis, incluindo vírus influenza e SARS-CoV-2 em aerossóis.
Muitos vírus foram isolados de amostras respiratórias e de ar interno, incluindo adenovírus, coxsackievírus, vírus influenza, rinovírus, vírus do sarampo, RSV, SARS-CoV, MERS-CoV e SARS-CoV-2. A concentração de SARS-CoV-2 no ar de um quarto de hospital com dois pacientes com COVID-19, estava entre 6 e 74 TCID50 por litro (dose média de infecção de cultura de tecidos por litro).
A distribuição de vírions em diferentes tamanhos de partículas de aerossol, está relacionada ao seu local de geração, o mecanismo de produção e a gravidade da infecção no local de geração, que varia entre os diferentes vírus. É comumente assumido, que as concentrações virais em amostras clínicas, por exemplo, expectoração ou saliva, se traduzem diretamente na concentração em gotículas e aerossóis gerados a partir do fluido respiratório, ou seja, que a carga viral se escala com o volume inicial de gotículas e aerossóis. No entanto, amostras segregadas por tamanho de aerossóis coletados no ar exalado de indivíduos infectados com vírus influenza A ou B, vírus parainfluenza, coronavírus, hRV ou RSV, e ar coletado em vários ambientes, mostram que os vírus são enriquecidos em aerossóis menores.
Em amostras coletadas de pacientes com influenza enquanto respiram, falam e/ou tossem, mais da metade do RNA viral foi encontrado em aerossóis < 4 a 5 μm. Um estudo de vários vírus respiratórios encontrou RNA viral mais comumente em pequenos (< 5 μm) do que em grandes aerossóis. A distribuição do vírus influenza e RSV em aerossóis ambientais, medidos em uma clínica médica, revelou que 42% do RNA do vírus influenza A, mas apenas 9% do RNA do RSV, estava em aerossóis ≤ 4 μm. Em um estudo que coletou aerossóis em uma clínica de saúde, creche e aviões, mais da metade do RNA do vírus influenza A foi encontrado em aerossóis < 2,5 μm.
=> Um estudo descobriu que um subconjunto de pacientes com COVID-19 libera de 105 a 107 cópias do genoma do SARS-CoV-2 por hora no ar exalado, enquanto outros não exalam vírus detectáveis. A grande variabilidade interpessoal tanto no número de aerossóis produzidos, quanto em sua carga viral, pode contribuir para a superdispersão na transmissão de COVID-19, um componente crucial em eventos de superespalhamento.
Embora os vírus infecciosos sejam enriquecidos em pequenos aerossóis, a relação dose-resposta que governa a probabilidade de infecção, dada a exposição a um certo número de vírions, ainda precisa ser determinada. Em um hospedeiro suscetível, a dose infecciosa mínima varia com base no tipo de vírus, e local de deposição no trato respiratório, de modo que a inalação de aerossóis menores, que se depositam mais profundamente nos pulmões, pode exigir menos vírus para iniciar a infecção.
Estudos sobre o vírus influenza, mostraram que a dose necessária para iniciar a infecção em humanos, em termos de unidades formadoras de placa (PFU), é, para a inalação de aerossóis, cerca de um centésimo do tamanho da dose para inoculação intranasal. A caracterização aprimorada da carga viral e da distribuição de vírions infecciosos em aerossóis individuais em função do tamanho da partícula, para diferentes pessoas e estágios da doença, contribuirá muito para o nosso entendimento da transmissão aérea de vírus respiratórios.
Aerossóis carregados de vírus no meio ambiente
As características físicas dos aerossóis afetam seu transporte no ar. A velocidade inicial dos aerossóis respiratórios, depende de como eles são gerados e liberados no trato respiratório; por exemplo, a tosse produz gotículas e aerossóis liberados em velocidades mais altas do que a fala. O transporte do aerossol é controlado por uma combinação de fluxo de ar e propriedades ambientais, e pelas características físicas dos próprios aerossóis. Aerossóis podem divergir das linhas aerodinâmicas como resultado da inércia, movimento browniano e forças externas, incluindo forças gravitacionais, eletroforéticas e termoforéticas. Esses movimentos também podem levar à remoção do ar por deposição nas superfícies. A vida útil dos vírus no ar é uma função do transporte físico e da inativação biológica, que são afetados por fatores ambientais, como temperatura, umidade e radiação ultravioleta (UV).
Os tamanhos dos aerossóis exalados que permanecem no ar evoluem com o tempo, como resultado da evaporação, coagulação e/ou deposição. A evaporação da água de aerossóis aquosos é normalmente descrita pela equação de Hertz-Knudsen. No entanto, como os aerossóis respiratórios contêm componentes não voláteis, incluindo proteínas, eletrólitos e outras espécies biológicas, a taxa de evaporação é mais lenta do que a da água pura. Durante a evaporação, os aerossóis estão sujeitos a mudanças na fase, morfologia, viscosidade e pH, todos os quais foram estudados em aerossóis respiratórios simulados, mas não reais. Mudanças nas características físicas dos aerossóis afetarão o transporte e o destino de quaisquer vírus que eles contenham, e as mudanças associadas nas características químicas dos aerossóis podem afetar a viabilidade do vírus. As distribuições gerais de tamanho de aerossóis carregados de vírus no ar também evoluem ao longo do tempo, porque aerossóis maiores são preferencialmente removidos por sedimentação para o solo ou outras superfícies, fazendo com que a mediana da distribuição mude para tamanhos menores.
O tempo de residência dos aerossóis carregados de vírus no ar, é crucial para determinar seu alcance de propagação. Na ausência de outras forças, o tempo de residência de um aerossol de tamanho específico está relacionado à sua velocidade terminal de sedimentação, up, resultante de um equilíbrio entre a força de arrasto viscosa e a força gravitacional, conforme descrito pela lei de Stokes, para pequenas partículas sujeitas a fluxo laminar.
=> O tempo de estabilização para aerossóis de um tamanho específico para atingir o solo pode, portanto, ser estimado com base na suposição de que o ar circundante está em repouso. No ar parado, um aerossol de 5 μm leva 33 minutos para se estabelecer no solo de uma altura de 1,5 m, enquanto um aerossol de 1 μm pode permanecer suspenso no ar por > 12 horas.
=> No entanto, na maioria dos ambientes realistas, a velocidade do fluxo de ar ao redor deve ser levada em consideração. Além disso, quando os aerossóis respiratórios são exalados, essas partículas são contidas em uma pluma úmida exalada com velocidade e trajetória próprias, que também desempenham um papel na determinação da distância e direção final alcançável. A distância que os aerossóis carregados de vírus viajam depende do tamanho do aerossol, da velocidade inicial do fluxo que os transporta e de outras condições ambientais, como a velocidade do vento externo ou correntes de ar internas induzidas por ventilação natural ou aquecimento, ventilação e sistemas de ar-condicionado (HVAC). A concentração de aerossóis exalados é mais alta perto da fonte (isto é, o indivíduo infeccioso) e diminui com a distância conforme a pluma respiratória se mistura com o ar ambiente.

Quanto tempo os aerossóis podem permanecer no ar? O tempo de residência de aerossóis de tamanhos variados no ar parado pode ser estimado a partir da lei de Stokes para partículas esféricas. Por exemplo, o tempo necessário para um aerossol de 100, 5 ou 1 μm cair no solo (ou superfícies) de uma altura de 1,5 m é 5 s, 33 min ou 12,2 horas, respectivamente.
=> A trajetória e a evaporação dos aerossóis exalados gerados durante a tosse e a fala foram estudadas com modelagem computacional. Gotas grandes tendem a atingir suas distâncias horizontais máximas rapidamente, e cair no solo ou superfícies em poucos metros, enquanto os aerossóis podem permanecer suspensos por muitos segundos a horas, viajar por longas distâncias, e se acumular no ar em espaços mal ventilados. A natureza multifásica dos fluxos de aerossol carregados de vírus afeta muito a dinâmica do fluxo e a distância que os aerossóis viajam, especialmente para expirações com velocidades de fluxo de ar mais altas, como em uma tosse.
Fatores ambientais que afetam a transmissão do aerossol
A sobrevivência de vírus em aerossóis, também conhecida como persistência, estabilidade ou retenção de infectividade, é comumente determinada experimentalmente usando um tambor rotativo, que permite que os aerossóis permaneçam suspensos por mais tempo do que em uma câmara estacionária. A decadência do vírus pode ser descrita por cinética de primeira ordem C = Co × e-kt onde C é a concentração de vírus infecciosos no tempo t, Co é a concentração inicial de vírus infecciosos ek é a constante de taxa de inativação. A constante da taxa de inativação difere por vírus e depende de vários fatores, incluindo temperatura, umidade, radiação UV e composição química do fluido a partir do qual o vírus foi aerossolizado. Essa dependência, especialmente da composição do fluido respiratório, torna um desafio comparar os resultados de diferentes estudos. O tempo necessário para atingir 99,99% de inativação varia de horas a meses. A taxa de decaimento pode ser quantificada em termos de meia-vida, que é de aproximadamente 1 a 3 horas para SARS-CoV e SARS-CoV-2 em aerossóis gerados em laboratório.
Temperatura
A temperatura é crítica na mediação da sobrevivência e transmissão de vírus em aerossóis, provavelmente por afetar a estabilidade das proteínas, lipídios e material genético, que constituem o vírus. O trato respiratório superior é mantido alguns graus mais frios do que os pulmões, sugerindo um aumento da capacidade de replicação no trato respiratório superior. SARS-CoV, SARS-CoV-2 e vírus influenza são mais estáveis em temperaturas mais baixas, possivelmente por causa de taxas de decaimento mais lentas, conforme governado pela equação de Arrhenius, e ordenação mais forte de fosfolipídios para vírus envelopados.
=> Evidências epidemiológicas e estudos em animais sugerem que a transmissão de vírus respiratórios que infectam as vias aéreas superiores é favorecida em temperaturas mais baixas.
Umidade relativa
Ao modular a taxa de evaporação e o tamanho de equilíbrio dos aerossóis, a umidade relativa (UR) afeta seu transporte e a viabilidade dos vírus que eles contêm. Os aerossóis respiratórios evaporam ao serem liberados do trato respiratório para o ar ambiente, à medida que passam de um ambiente saturado para uma UR mais baixa. Espera-se que o processo de evaporação leve segundos. Na UR ambiente mais baixa, a evaporação ocorre mais rapidamente e se equilibra em um tamanho de equilíbrio menor. Em UR abaixo de ~ 80%, os aerossóis respiratórios atingem um diâmetro final que é de 20 a 40% do tamanho original.
A sazonalidade dos casos de vírus influenza, coronavírus humanos que causam resfriados comuns, VSR e outros, foi pelo menos parcialmente atribuída à UR. A sensibilidade de um vírus à UR pode ser influenciada pelos efeitos relacionados à UR na persistência do vírus no ambiente e/ou nas defesas imunológicas. A depuração mucociliar não é tão eficiente em baixa UR. Estudos em animais demonstraram que a transmissão do vírus influenza é favorecida com UR baixa; no entanto, um estudo do vírus da pandemia de influenza A (H1N1) de 2009 em meio mais fisiologicamente realista, relatou que o vírus permaneceu altamente estável e infeccioso, em uma ampla faixa de UR entre 20 e 100%. Um estudo investigou a sensibilidade de 11 vírus aerotransportados à UR e descobriu que, embora alguns vírus de RNA sobrevivam melhor com UR baixa, outros vírus sobreviveram melhor com UR alta. A relação entre a UR e a viabilidade do vírus em gotículas e aerossóis, é característica do vírus, modulada por ambas as propriedades físico-químicas intrínsecas do vírus, e do seu ambiente circundante.
Irradiação Ultravioleta (UV)
=> A irradiação com luz ultravioleta, foi estabelecida há muito tempo, como uma abordagem eficaz para inativar vírus transportados pelo ar, incluindo vírus influenza, SARS-CoV e outros coronavírus humanos. A irradiação UV inativa rapidamente o SARS-CoV-2 em meio de cultura em massa e em aerossóis em comprimentos de onda encontrados na luz solar ao nível do solo. A irradiação ultravioleta danifica o material genético, levando à inativação do vírus. No entanto, deve-se ter cuidado durante a operação das lâmpadas de desinfecção UV para evitar o contato direto com os olhos e a pele.
Fluxo de ar, ventilação e filtração
=> O fluxo de ar influencia fortemente o transporte de aerossóis carregados de vírus, em contraste com as gotículas, que são rapidamente depositadas por causa da gravidade. Aerossóis no ar exalado tendem a subir, porque o ar exalado é mais quente do que o ambiente, e suas trajetórias também podem ser influenciadas pela pluma térmica do corpo. Maior fluxo de ar externo contribui para maior dispersão, enquanto dentro de casa o fluxo de ar é restringido pelas paredes e teto ao redor. A taxa de ventilação e os padrões de fluxo de ar, desempenham um papel importante na transmissão aérea de vírus em ambientes internos.
Um estudo de transmissão de rinovírus, mostrou que uma baixa taxa de ventilação, aumenta o risco de exposição a aerossóis carregados de vírus em ambientes fechados. Um surto de COVID-19 em um allto prédio de apartamentos, ocorreu ao longo de unidades alinhadas verticalmente, que foram conectadas por um único duto de ar, demonstrando o risco de transmissão aérea associada ao ar compartilhado. Melhorar as taxas de ventilação, para reduzir os níveis de dióxido de carbono em edifícios sub-ventilados, de 3.200 partes por milhão (ppm) para 600 ppm, correspondendo a um aumento estimado da taxa de ventilação de 1,7 litros por segundo por pessoa para 24 litros por segundo por pessoa, demonstrou reduzir a taxa de ataque secundário de tuberculose a zero.
=> O fluxo de ar em ambientes internos é mediado pelo projeto e status operacional dos sistemas de ventilação, incluindo o tipo de sistema de ventilação, seja natural com portas e janelas abertas, mecânico com ventiladores ou um híbrido destes padrões de fluxo de ar, taxa de renovação de ar, e sistemas suplementares, como filtração de ar. A OMS recomendou recentemente uma taxa de ventilação de 10 litros por segundo por pessoa. A colocação adequada de purificadores portáteis de partículas de ar de alta eficiência (HEPA), que são capazes de remover ≥ 99,97% das partículas de aerossol ≥ 0,3 μm, também é eficaz na redução da exposição de aerossóis infecciosos, especialmente quando combinados com ventilação e mascaramento universal.
Embora a ventilação e a filtração ajudem a remover os aerossóis carregados de vírus, elas devem ser implementadas corretamente, para reduzir a disseminação e o risco de inalação do aerossol. Um estudo avaliou quantitativamente o risco de transmissão aérea de COVID-19 por indivíduos assintomáticos em elevadores, salas de aula e configurações de supermercado, combinando medições in situ e simulações de dinâmica de fluidos computacional, mostrando que a ventilação inadequada pode criar pontos de acesso com riscos muito maiores do que em outros locais da sala.

A simulação de transporte e deposição de partículas para avaliar o risco em:
(A) uma configuração em elevador com uma pessoa assintomática com uma respiração sob alta ventilação (filme suplementar S1), falando sob alta ventilação (filme suplementar S2) e falando sob baixa ventilação (filme suplementar S3),
(B) um pequeno ambiente de sala de aula com um professor assintomático e o sistema de ventilação de teto localizado na parte de trás (a parte superior da figura, filme suplementar S4) e na frente da sala (a parte inferior da figura, filme suplementar S5), respectivamente,
(C) um pequeno supermercado com um comprador assintomático (suas 10 paradas ao longo da rota tracejada estão marcadas no esquema), e o sistema de ventilação de teto localizado no canto traseiro (parte superior da figura, filme suplementar S6) e entrada do supermercado (parte inferior da figura, filme suplementar S7), respectivamente.
Exceto para a configuração de ventilação baixa em A, a taxa de ventilação de cada configuração é projetada para substituir todo o ar no espaço a cada 2 minutos, representando o limite superior da condição de ventilação recomendada de cada configuração. Em cada configuração, o risco de uma pessoa encontrar partículas contendo vírus em um local específico, é avaliado como o número total de partículas que passam por esse local durante o tempo de simulação, o que pode ser interpretado como o número de partículas que uma pessoa pode inalar nesta localização durante o tempo simulado.
Além disso, as barreiras físicas de acrílico projetadas para bloquear a pulverização de gotículas de tosses e espirros em espaços internos, podem impedir o fluxo de ar e até mesmo reter concentrações mais altas de aerossóis na zona de respiração, e foi demonstrado que aumentam a transmissão de SARS-CoV-2.

Fatores que afetam a transmissão aérea interna. Enquanto o movimento de gotas grandes é predominantemente governado pela gravidade, o movimento dos aerossóis é mais fortemente influenciado pela direção e padrão do fluxo de ar, tipo de ventilação e filtragem e desinfecção do ar.
Um modelo usando o método Wells-Riley, foi aplicado a um grande surto comunitário de COVID-19 em uma clínica de coral, com um caso índice conhecido por ser sintomático, que levou a 53 casos entre 61 membros presentes (87% de taxa de ataque secundário), que concluíram que a ventilação deficiente, juntamente com um local lotado, vocalização alta e longa duração, contribuíram para a alta taxa de ataque secundário. A prática do coral limitou a interação face a face, e grande atenção na desinfecção das mãos, o que permitiu que grandes contribuições de fômites ou transmissão de gotículas fossem descartadas. Pesquisas são necessárias para estabelecer taxas de ventilação mínimas aceitáveis sob diferentes condições, e o efeito do tipo de ventilação sobre o risco de transmissão.
Deposição de aerossóis carregados de vírus
Uma vez inalados, os aerossóis carregados de vírus podem se depositar no trato respiratório de um hospedeiro potencial. O tamanho dos aerossóis é novamente central para determinar o local de deposição, embora vários fatores anatômicos, fisiológicos e aerodinâmicos, incluindo a estrutura anatômica das vias aéreas, padrões respiratórios, aerodinâmica de transporte de aerossol no trato respiratório e as propriedades físico-químicas dos aerossóis inalados, também afetem o padrão de deposição. A infecção pode ser iniciada no local de deposição se o vírus permanecer infeccioso, e os receptores apropriados estiverem presentes.
Aerossóis de até 100 μm podem ser inalados. Dependendo de seu tamanho, eles se depositam em diferentes regiões do trato respiratório, com base em um dos vários mecanismos principais, incluindo impactação inercial, sedimentação gravitacional, difusão browniana, precipitação eletrostática e interceptação. Após a inalação, o tamanho dos aerossóis inalados pode aumentar como resultado do crescimento higroscópico no trato respiratório quase saturado. O Comitê Internacional de Proteção Radiológica desenvolveu um modelo, baseado na arquitetura do pulmão humano, que quantifica a eficiência da deposição em função do tamanho do aerossol.
=> Aerossóis > 5 µm se depositam principalmente na região nasofaríngea (87 a 95%), principalmente por impactação inercial e sedimentação gravitacional; embora aerossóis < 5 μm também se depositem lá, eles também podem penetrar mais profundamente nos pulmões e se depositar no lúmen alveolar.
A difusão browniana é o mecanismo de deposição dominante de partículas inaladas < 0,1 μm nas regiões bronquiolar e alveolar. Aerossóis que carregam carga eletrostática natural, podem ser atraídos para as paredes das vias aéreas. Desde que um receptor celular esteja presente no local de deposição, a infecção pode ser iniciada. A eficiência da infecção é ainda governada pela distribuição de receptores celulares ao longo do trato respiratório, e pela interação vírus-hospedeiro.

Mecanismos de deposição de aerossol dependentes do tamanho em locais no trato respiratório.
(A) Principais mecanismos de deposição e regimes de fluxo de ar correspondentes em diferentes regiões do trato respiratório humano. Grandes aerossóis tendem a se depositar na região nasofaríngea como resultado da impactação inercial, enquanto pequenos aerossóis tendem a se depositar nas regiões traqueobrônquica e alveolar, com base na sedimentação gravitacional e difusão browniana. Uma visão ampliada das regiões traqueobrônquica e alveolar ilustra o mecanismo de deposição.
(B) A eficiência de deposição de aerossóis em diferentes regiões do trato respiratório em função do diâmetro do aerossol, com base no modelo de deposição pulmonar ICRP é mostrada. A maioria dos grandes aerossóis se deposita na região nasofaríngea; apenas aerossóis suficientemente pequenos podem atingir e se depositar na região alveolar.
A deposição de aerossóis em pulmões doentes pode diferir daquela em pulmões normais, por causa das mudanças na estrutura da superfície das vias aéreas e obstrução por muco. Mudanças nas propriedades de superfície do epitélio respiratório nas vias aéreas de asmáticos, e no estreitamento das vias aéreas como resultado da doença pulmonar obstrutiva crônica (DPOC), alteram o fluxo de ar e o comportamento aerodinâmico dos aerossóis inalados, modificando assim sua dinâmica e locais de deposição. A deposição é geralmente maior em pacientes com DPOC do que em indivíduos saudáveis; a deposição brônquica é maior em pacientes com asma e bronquite crônica.
=> Como os vírus são enriquecidos em pequenos aerossóis (< 5 µm), eles podem penetrar mais profundamente e se depositar no trato respiratório inferior. Foi relatado que a carga viral de SARS-CoV-2 é maior e o vírus persiste por mais tempo, no trato respiratório inferior, em comparação com o trato respiratório superior. O início de uma infecção no trato respiratório inferior acrescenta desafios técnicos no diagnóstico de pacientes, porque a triagem atual comumente coleta amostras da cavidade nasofaríngea ou oral usando esfregaços.
Discussão
A transmissão aérea, tem sido uma rota subestimada por contribuir para a transmissão de doenças virais respiratórias, em grande parte por causa de uma compreensão insuficiente dos processos de geração e transporte de aerossóis carregados de vírus, bem como a atribuição incorreta de observações anedóticas. A evidência epidemiológica para o domínio da disseminação aérea do SARS-CoV-2 aumentou com o tempo e se tornou especialmente forte.
=> Em primeiro lugar, a diferença distinta entre a transmissão interna e externa não pode ser explicada pela transmissão por gotículas, porque as gotículas acionadas pela gravidade se comportam de forma idêntica em ambientes internos e externos. A alta frequência de eventos de superespalhamento internos em relação aos externos, aponta para a importância da transmissão aérea. O papel demonstrado da má ventilação na transmissão e aglomerados de superespalhamento em ambientes fechados, também é compatível apenas com aerossóis, porque as gotículas e a transmissão dos fômites, não são afetadas pela ventilação. A transmissão aérea de longo alcance do SARS-CoV-2, foi observada em quarentenas de hotéis em países com transmissão muito baixa, e em uma grande igreja.
Durante o surgimento de novos vírus respiratórios, é necessária uma abordagem mais holística que reconheça todos os modos de transmissão, pelo ar, gotículas e fômites, para mitigar com sucesso o risco e prevenir a disseminação. A exigência de evidência direta de infectividade de amostras de aerossóis, antes de reconhecer e adicionar controles para lidar com a transmissão aérea, deixa as pessoas em risco potencial. Quando livre de definições convencionais de rotas de transmissão, a evidência disponível para SARS-CoV-2, vírus influenza e outros vírus respiratórios, é muito mais consistente com a transmissão por aerossóis < 100 μm, do que por gotas raras e grandes borrifadas nas membranas mucosas das pessoas muito próximo. O recente reconhecimento da transmissão aérea do SARS-CoV-2 pela OMS e pelo CDC dos EUA, reforça a necessidade de implementar proteção contra essa rota de transmissão em distâncias curtas e longas.
Uma vez que os mecanismos que levam à transmissão aérea são totalmente compreendidos, reconhecendo que a transmissão por aerossóis é maior a curta distância, torna-se claro que há uma sobreposição nas precauções e medidas de mitigação para gotas e aerossóis, como distanciamento e máscaras, mas medidas extras devem ser levadas em consideração, para mitigar a transmissão de aerossóis em distâncias curtas e longas. Isso inclui atenção à ventilação, fluxos de ar, tipo e ajuste da máscara, filtragem de ar e desinfecção por radiação ultravioleta, bem como medidas de distinção, entre ambientes internos e externos. Embora nosso conhecimento ainda esteja aumentando, já se sabe o suficiente para adicionar medidas de proteção, para melhor proteger contra a transmissão aérea de vírus respiratórios, observando que as “precauções com gotículas” não são substituídas, mas expandidas.
=> Uma alta proporção de indivíduos infectados com SARS-CoV-2 não apresenta sintomas no momento do teste. Cerca de 20 a 45% dos indivíduos infectados com SARS-CoV-2, permaneceram assintomáticos durante o curso da infecção, enquanto alguns indivíduos infectados experimentaram uma fase pré-sintomática, e começaram a desenvolver sintomas vários dias após a infecção. A infectividade do SARS-CoV-2 atinge o pico dois dias antes, e se estende até um dia após o início dos sintomas.
Altas taxas de infecção assintomática, também foram relatadas para o vírus da gripe e outras infecções respiratórias virais. Embora alguns estudos sugiram que a transmissão aérea não é uma via eficiente, particularmente para indivíduos assintomáticos e levemente sintomáticos, que provavelmente têm cargas virais baixas em sua saliva, a carga viral em indivíduos pré-sintomáticos é comparável à de pacientes sintomáticos.
É importante implementar controles, que protejam contra a exposição de aerossóis infecciosos carregados de vírus produzidos, quando indivíduos infectados sem quaisquer sintomas falam, cantam ou simplesmente respiram. Como esses indivíduos não sabem que estão infectados, geralmente continuam envolvidos em atividades sociais, levando à transmissão pelo ar.
=> O mascaramento universal é uma forma eficaz e econômica de bloquear aerossóis carregados de vírus. Simulações de modelo mostram que as máscaras previnem efetivamente a transmissão assintomática, e reduzem o número total de indivíduos infectados, bem como a mortalidade como resultado do COVID-19. É crucial otimizar o uso de máscaras.
Foi demonstrado que as máscaras cirúrgicas reduzem a liberação no ar por indivíduos infectados de vírus influenza, coronavírus humanos sazonais e rinovírus em aerossóis < 5 μm em até 100%, embora para alguns indivíduos possa não haver redução; e as máscaras são mais eficazes para limitar as gotículas. Máscaras feitas de combinações de diferentes tecidos e/ou camadas múltiplas, quando usadas de maneira adequada e sem vazamentos, podem bloquear até 90% das partículas entre 0,5 e 10 μm. Pequenos espaços entre o material da máscara e a pele, podem levar a diminuições substanciais na eficiência geral da filtração. Para aerossóis < 2,5 μm, a eficiência de filtração diminui em 50% para uma área de vazamento relativa de 1%.
=> Um estudo comparou a eficiência de filtração viral do N95, de máscaras cirúrgicas e de máscaras tecido, usando um vírus modelo, e descobriu que a eficiência do N95 e de algumas máscaras cirúrgicas excedeu 99%; e todas as máscaras de tecido testadas foram pelo menos 50% eficientes. A eficácia das máscaras N95, cirúrgicas e de algodão no bloqueio de aerossóis contendo SARS-CoV-2, foi investigada usando manequins colocados face a face. As máscaras N95 demonstraram a maior eficiência no bloqueio do SARS-CoV-2 infeccioso. Quase todas as máscaras oferecem pelo menos alguma proteção, mas não são 100% eficazes.
=> A transmissão de SARS-CoV-2 ocorreu em ambientes de saúde, apesar do uso das máscaras médicas (projetadas para gotículas, não para aerossóis), e do uso de proteção para os olhos, o que ilustra a necessidade de equipamento de proteção individual (EPI) adequado, e múltiplas intervenções em camadas contra a transmissão aérea, especialmente em ambientes internos de alto risco. Os estabelecimentos de saúde têm maior probabilidade de acomodar pacientes infectados com vírus respiratórios. Portanto, o pessoal de saúde deve receber EPI adequado para reduzir a exposição no ar.
=> Pessoas que ocupam espaços internos, têm maior potencial de exposição a altas concentrações de aerossóis carregados de vírus, especialmente em ambientes internos mal ventilados e/ou lotados, onde os aerossóis carregados de vírus podem se acumular prontamente. Medidas preventivas devem ser implementadas em todos os momentos ao viajar em aviões, trens, ônibus, navios e navios de cruzeiro, que têm espaços aéreos relativamente pequenos e fechados, onde a ventilação pode nem sempre ser a ideal.
=> Muitos estudos indicam, que o risco de transmissão aérea em ambientes externos, é substancialmente menor do que em ambientes internos; no entanto, o risco de transmissão ao ar livre existe em situações de proximidade, especialmente se falando, cantando ou gritando por um tempo prolongado. O risco de transmissão externa pode aumentar com o aumento da vida útil e da transmissibilidade de vírus, como certas variantes do SARS-CoV-2.
A aerossolização de águas residuais contendo vírus e de descargas fecais de hospitais, também apresentam riscos potenciais de exposição ao ar livre, que não devem ser subestimados. Implementar sistemas de ventilação eficazes, reduz a transmissão aérea de aerossóis infecciosos carregados de vírus. Estratégias como garantir taxas de ventilação suficientes, e evitar a recirculação são recomendadas. Os sensores de dióxido de carbono podem ser usados como indicadores do acúmulo de ar exalado, e servir como uma maneira simples de monitorar e otimizar a ventilação. Os sensores de aerossol também podem ser usados para avaliar as eficiências de filtração de aerossol HEPA e HVAC, que são essenciais para reduzir as infecções causadas por aerossóis carregados de vírus.
=> Garantir uma taxa de ventilação mínima de 4 a 6 renovações de ar por hora e manter os níveis de dióxido de carbono abaixo de 700 a 800 ppm são recomendados, embora o tipo de ventilação e a direção, e o padrão do fluxo de ar, também devam ser levados em consideração. Aumentar a eficiência da filtragem de ar em sistemas HVAC, purificadores HEPA autônomos, ou implementar sistemas de desinfecção por radiação UV na parte superior da sala, pode reduzir ainda mais as concentrações de aerossóis carregados de vírus.
=> O distanciamento físico, uma mitigação posta em prática para lidar com a transmissão de gotículas, também é eficaz na redução das chances de inalação de aerossol, porque as concentrações de aerossol são muito maiores na proximidade de um indivíduo infectado. A OMS e muitas agências nacionais de saúde pública, recomendam manter distâncias físicas de 1 ou 2 metros. No entanto, essa distância não é suficiente para proteger contra aerossóis que viajam além desse intervalo.
Se grandes gotas dominassem a transmissão, o distanciamento, por si só, já teria suprimido efetivamente a transmissão do SARS-CoV-2. Como foi repetidamente mostrado em eventos de superespalhamento, a transmissão aérea ocorre em quartos mal ventilados, quando os ocupantes inalam ar ambiente infeccioso. Além disso, embora o distanciamento ajude a afastar as pessoas das partes mais concentradas das nuvens respiratórias, o distanciamento, por si só, não para a transmissão e não é suficiente sem levar em conta outras medidas, como ventilação e filtração, o número de pessoas emitindo aerossóis infecciosos, e o quantidade de tempo gasto em espaços fechados.
O número desconhecido de indivíduos infectados assintomáticos (incluindo pré-sintomáticos) presentes em ambientes ambientais específicos, é um desafio adicional no controle das doenças respiratórias. Medidas de engenharia para reduzir as concentrações de aerossol por meio de ventilação, filtração e desinfecção por radiação UV da sala superior, continuam sendo estratégias críticas, para reduzir os riscos de transmissão pelo ar.
Apesar do reconhecimento emergente da transmissão aérea de vírus respiratórios, vários problemas requerem uma exploração mais aprofundada. Por exemplo, medições diretas são necessárias da concentração de vírus em aerossóis e gotículas, em função do seu tamanho e de seu potencial para iniciar uma nova infecção. O tempo de vida dos vírus em aerossóis de tamanhos variados, requer outra investigação sistemática. Mais estudos são necessários para quantificar a relação entre a dose viral fornecida por aerossóis e gotículas, e a gravidade da infecção; essa relação provavelmente varia consideravelmente para vírus diferentes. Também é importante investigar se a gravidade da doença, se correlaciona com o tamanho e número de aerossóis, e o local em que são depositados no trato respiratório.
=> Embora mais estudos sejam necessários, evidências inequívocas indicam que a transmissão aérea é uma das principais vias de disseminação do SARS-CoV-2 e de muitos outros vírus respiratórios. Medidas de precaução adicionais devem ser implementadas para mitigar a transmissão de aerossol em distâncias curtas e longas, com foco principal em ventilação, fluxos de ar, filtração de ar, desinfecção UV e ajuste da máscara.
Essas intervenções são estratégias críticas para ajudar a acabar com a pandemia atual, e prevenir surtos futuros. É importante observar que essas medidas propostas para melhorar a qualidade do ar interno, levarão a melhorias há muito esperadas, que têm benefícios para a saúde que vão muito além da pandemia da COVID-19.

Estudo identifica fatores de risco para asma grave de início na idade adulta
Fatores de risco independentes para asma grave de início na idade adulta incluem tabagismo, sexo masculino, comorbidades, doença respiratória exacerbada por antiinflamatórios não esteroidais (AINE), e ter pelo menos 2 irmãos com a doença, de acordo com um estudo publicado na BMC Pulmonary Medicine. Os pesquisadores ainda sugeriram que esses fatores de risco eram cumulativos, com cada fator de risco adicional aumentando o risco de asma autorreferida.
A detecção precoce dos fatores de risco, é crucial para diminuir a morbidade e os custos associados à asma grave de início na idade adulta, observaram os pesquisadores, que procuraram identificar a combinação dos fatores de risco envolvidos, por meio de um estudo de coorte caso-controle de base populacional.
Na coorte final, 100 pacientes (idade média, 58,7 anos) apresentaram asma grave autorreferida. Asma grave foi definida como asma autorreferida, e sintomas que causaram prejuízo e danos regulares, juntamente com a necessidade de pelo menos 1 curso de corticosteroide oral por ano; uso regular de corticosteroides orais; ou acordar durante a noite devido a sintomas algumas vezes por mês.
Usando os achados da revisão da literatura, os pesquisadores identificaram 16 covariáveis, cobrindo características pessoais, educação, estilo de vida, fatores da infância, características da asma e múltiplas comorbidades, que foram avaliadas para determinar sua associação com asma grave.
Por meio de regressão multivariada, os pesquisadores identificaram os fatores de risco associados à asma grave autorreferida como: sexo, fumar, comorbidades crônicas, tendo 2 ou mais irmãos asmáticos e doença respiratória exacerbada por AINE. Além disso, a soma desses 5 fatores de risco identificados foi associada a um aumento significativo e gradual no risco de asma grave de início na idade adulta.
Os pesquisadores disseram que os resultados do estudo "reforçam a necessidade de parar de fumar e a importância do diagnóstico e do tratamento de doença respiratória exacerbada por AINE e outras comorbidades, para prevenir asma grave em pacientes com asma de início adulto", também observando que os resultados exigem mais validação em populações adicionais.

Asma leve e bem controlada pode se sair melhor com corticosteroides inalatórios contínuos
Os corticosteroides inalatórios (CIs) são recomendados como tratamento de primeira linha para a asma brônquica, mas muitos médicos são desafiados a determinar se os pacientes com asma leve e bem controlada, devem continuar ou descontinuar o tratamento com os CIs.
Pesquisas anteriores sugerem que, para pacientes com asma leve, a asma pode continuar a ser bem controlada após a interrupção da terapia de primeira linha. No entanto, um novo estudo de longo prazo sugere, que manter o tratamento com os CIs pode levar a um melhor controle e resultados mais favoráveis para alguns pacientes com doença leve, persistente e bem controlada.
A adesão à terapia para asma pode ser difícil para muitos pacientes, e a falta de adesão, geralmente leva a exacerbações da asma. Embora a terapia com os CIs seja geralmente recomendada, há um risco potencial de longo prazo para certos efeitos colaterais. Dado esse risco de possíveis efeitos adversos, os médicos às vezes são chamados para determinar se o CI pode ser descontinuado ou substancialmente reduzido, para pacientes cuja doença está bem controlada.
No estudo DISCO (descontinuação de esteróide inalado em asmáticos controlados ao longo de 6 meses), os pesquisadores examinaram os resultados clínicos de pacientes com asma leve bem controlada, para os quais o CI foi descontinuado. Os pesquisadores compararam os resultados desses pacientes com os resultados dos pacientes que continuaram recebendo terapia com CIs por aproximadamente 3 anos. Os resultados do estudo foram publicados online em 1º de julho no Annals of Allergy, Asthma and Immunology.
Os pesquisadores observaram, uma diferença significativa no tempo até a perda do controle da doença, entre aqueles para os quais o CI foi interrompido, em comparação com aqueles cuja terapia foi continuada (taxa de risco, 2,56).
Houve uma associação significativa, embora fraca, entre o risco de perder o controle da doença e os níveis crescentes de óxido nítrico exalado fracionado, e contagens de eosinófilos no escarro no grupo CI contínuo.
Foram observadas contagens de eosinófilos no escarro significativamente maiores, e níveis séricos mais elevados de imunoglobulina E total, no grupo que perdeu o controle, em comparação com o grupo que continuou a terapia e atingiu o controle estável da doença.
Os pacientes nem sempre fazem o que os médicos recomendam, nem usam medicamentos de forma consistente, uma vez que sentem que estão indo melhor ou estão indo bem. Muitos pacientes param de tomar medicamentos assim que sentirem que seus sintomas estão controlados. Mas os benefícios de continuar com os CIs incluem melhorias ou maior manutenção no controle da asma e diminuição da inflamação nos pulmões.
As desvantagens do uso de CIs incluem os custos da medicação, bem como a possível absorção sistêmica com efeitos colaterais. Mesmo que a absorção sistêmica de esteróides de CIs seja muito menor do que esteróides orais, ainda pode haver efeitos colaterais com qualquer medicamento, então é importante tentar usar a menor quantidade de medicamento necessária para controlar os sintomas.
Para pacientes com asma que são tratados com os CIs, alguns podem piorar após essa terapia ser interrompida, enquanto outros não. Mas decidir descontinuar os CIs pode ser complicado. Continuar é uma opção, como diz o ditado, 'Se não está quebrado, não conserte. Interromper os CIs também faz sentido para certos pacientes, por que quem quer tomar os remédios de que não precisa?
Os médicos devem garantir que os pacientes que descontinuam os Cis, recebam educação adequada sobre a identificação e o manejo imediato dos sintomas, caso ocorram. Os médicos também devem monitorar a asma de maneira cuidadosa e rotineira após a retirada do CI. Continuar ou interromper os CIs deve ser baseado na tomada de decisão compartilhada entre pacientes, famílias e o clínico em exercício.
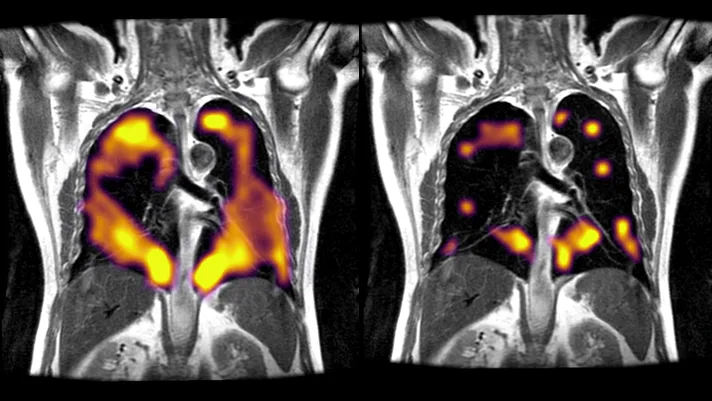
Danos pulmonares microscópicos podem continuar na 'Longa COVID'
Os problemas respiratórios persistentes, que afligem alguns sobreviventes de COVID-19, conhecidos como "Longa COVID", podem ser causados por processos microscópicos que continuam a danificar os pulmões, mesmo após o término da infecção aguda, sugerem novas descobertas.
Os pesquisadores estudaram amostras de sangue e do lavado broncoalveolar, de 38 pacientes que ainda apresentavam problemas respiratórios, pelo menos três meses após terem alta do hospital. Em comparação com voluntários saudáveis, as vias aéreas desses sobreviventes de COVID-19, apresentavam maior número de linfócitos citotóxicos (especialmente células T CD8 +), desidrogenase láctica e albumina (biomarcadores de morte celular e integridade de barreira).
"Curiosamente, mudanças semelhantes não foram encontradas ao comparar amostras de sangue, onde a composição das células imunológicas e proteínas, era semelhante à dos controles saudáveis", disse James Harker, do Imperial College London, co-autor de um relatório publicado no medRxiv antes da revisão por pares .
As descobertas, que ainda precisam de confirmação em estudos maiores, sugerem que alguns pacientes apresentam distúrbios contínuos em suas células imunológicas e danos às células que revestem as vias aéreas, mesmo vários meses após sua infecção inicial e a alta hospitalar. Em um pequeno grupo de pacientes, as anormalidades podem de fato se resolver com mais tempo.

Orientação para triagem para câncer de pulmão em fumantes com tomografia computadorizada de tórax de baixa dosagem
Em uma diretriz do painel de especialistas do American College of Chest Physicians, publicado online em 13 de julho no CHEST, são apresentadas recomendações para exames de tomografia computadorizada (TC) do tórax de baixa dosagem, para rastreamento do câncer de pulmão.
Os autores recomendam que a triagem anual com TC de baixa dose seja oferecida a indivíduos assintomáticos com idade entre 55 e 77 anos que fumaram 30 maços/ano ou mais, e continuaram a fumar ou pararam nos últimos 15 anos.
Os autores recomendam ainda que a TC de baixa dosagem não deve ser realizada para indivíduos que fumam menos de 30 maços/ano ou têm menos de 55 anos ou mais de 77 anos, ou que pararam de fumar há mais de 15 anos e, com base em calculadoras de predição de risco clínico, não tem um alto risco de ter ou desenvolver câncer de pulmão.
“Descrito nas recomendações é quem deve ser examinado e como deve ser o processo de rastreamento do lado clínico”, diz o comunicado. “Para um paciente individual, essas diretrizes destacam a importância da educação para promover decisões informadas e baseadas em valores sobre se deve ser examinado.”
Triagem para câncer de pulmão: Diretriz CHEST e relatório do painel de especialistas
1- Para fumantes assintomáticos e ex-fumantes de 55 a 77 anos que fumaram 30 maços/ano ou mais, e continuam a fumar ou pararam nos últimos 15 anos, sugerimos que seja oferecido um rastreamento anual com TC de baixa dose.
2- Para fumantes assintomáticos e ex-fumantes que não atendem aos critérios de tabagismo e idade na recomendação nº 1, mas são considerados de alto risco de ter/desenvolver câncer de pulmão, com base em calculadoras de predição de risco clínico, sugerimos que a TC de baixa dosagem não deve ser executado rotineiramente.
3- Para os indivíduos que acumularam menos de 30 maços/ano de fumo ou têm menos de 55 anos ou mais de 77 anos, ou pararam de fumar há mais de 15 anos, e não têm um alto risco de ter/desenvolver câncer de pulmão com base no risco clínico calculadores de previsão, recomendamos que a triagem de TC de baixa dose não seja realizada.
4- Para indivíduos com comorbidades, que influenciam adversamente sua capacidade de tolerar a avaliação dos achados detectados na triagem, ou tolerar o tratamento de um câncer de pulmão detectado em um estágio inicial de triagem, ou que limitam substancialmente sua expectativa de vida, recomendamos que a triagem por TC de baixa dosagem não seja realizada.
5- Sugerimos que os programas de triagem de TC de baixa dosagem, desenvolvam estratégias para determinar se os pacientes têm sintomas que sugerem a presença de câncer de pulmão, de modo que os pacientes sintomáticos não entrem nos programas de triagem, mas em vez disso, recebam o teste diagnóstico apropriado, independentemente de o paciente sintomático atender à elegibilidade para critério de triagem.
6- Sugerimos que os programas de triagem, definam o que constitui um teste positivo na TC de baixa dose, com base no tamanho de um nódulo de pulmão sólido ou parcialmente sólido detectado, com um limite para um teste positivo de 4 mm, 5 mm ou 6 mm de diâmetro.
7- Sugerimos que os programas de triagem de TC de baixa dosagem, desenvolvam estratégias para maximizar a conformidade com os exames anuais de triagem.
8- Sugerimos que os programas de triagem de TC de baixa dosagem, desenvolvam uma abordagem mais abrangente para o manejo de nódulos pulmonares, incluindo perícia multidisciplinar (Pulmonar, Radiologia, Cirurgia Torácica, Medicina e Oncologia de Radiação) e algoritmos para o manejo de pequenos nódulos sólidos, nódulos sólidos maiores e nódulos sub-sólidos, como por exemplo, a Fleischner Society.
9- Sugerimos que os programas de rastreamento de TC de baixa dosagem, desenvolvam estratégias para minimizar o tratamento excessivo de cânceres de pulmão potencialmente indolentes.
10- Para fumantes atuais, que estão sendo submetidos a exames de tomografia computadorizada de baixa dosagem, recomendamos que os programas de triagem forneçam tratamento para a cessação do tabagismo baseado em evidências, conforme recomendado pelo Serviço de Saúde Pública de cada país.
11- Sugerimos que os programas de triagem de TC de baixa dosagem, desenvolvam estratégias para fornecer aconselhamento eficaz e visitas de tomada de decisão compartilhadas, antes da realização do exame de triagem com a tomografia.
12- Sugerimos que os programas de rastreamento de TC de baixa dose, sigam os protocolos das sociedades de radiologia, para a realização das TC de tórax com baixa dose de radiação.
13- Sugerimos que os programas de triagem de TC de baixa dosagem, usem um sistema de relatório estruturado para relatar os resultados dos exames.
14- Sugerimos que os programas de rastreamento de tomografia computadorizada de baixa dosagem, desenvolvam estratégias para orientar o manejo de achados não nódulos.
15- Sugerimos que os programas de rastreamento de tomografia computadorizada de baixa dosagem, desenvolvam ferramentas de coleta de dados e relatórios, que sejam capazes de auxiliar nas iniciativas de melhoria da qualidade dos relatórios para o registro atual de cada país.




2 comentários